
【题目】下列关于有机物的说法中,正确的一组是
①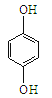 和
和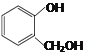 互为同系物
互为同系物
②蛋白质水解和油脂皂化都是高分子生成小分子的过程
③高分子材料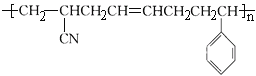 是由三种单体聚合而成的,该高分子材料是体型结构高分子,具有热固性
是由三种单体聚合而成的,该高分子材料是体型结构高分子,具有热固性
④C2H2 和C6H6不论二者以何种比例混合,只要总质量一定,则完全燃烧时消耗O2和生成的H2O的质量不变
⑤塑料、合成橡胶和合成纤维都是合成高分子材料
⑥棉花、蚕丝、人造丝的主要成分都是纤维素
A. ②③④⑤ B. ①③⑤ C. ④⑤ D. ①③④⑤⑥
科目:高中化学 来源: 题型:
【题目】下列有关铜片镀银的说法不正确的是
A.阳极反应式为Ag-e-=Ag+
B.铜片应与电源正极相连
C.电解液为AgNO3溶液
D.镀银过程中电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由两种短周期元素组成的化合物,其中两种元素的原子个数比为1:3,若两种元素的原子序数分别为a和b,则a和b的关系可能是( )
①a=b+4;②a+b=8;③a+b=30;④a=b+8
A. ①②③④ B. ①③④ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物转化关系是化学学习的重要内容之一。下列各组物质的转化关系中不全部是通过一步反应完成的是( )。
A. Na→NaOH→Na2CO3→NaCl B. Fe→Fe(NO3)3→Fe(OH)3→Fe2O3
C. Mg→MgCl2→Mg(OH)2→MgSO4 D. Al→Al2O3→Al(OH)3→AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物CH3CH==CH—C≡CH中标有“·”的碳原子的杂化方式依次为
A.sp、sp2、sp3B.sp3、sp、sp2C.sp2、sp、sp3D.sp3、sp2、sp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原子核外电子的能量与运动状态的说法正确的是
A.在同一原子中,2p、3p、4p……能级的电子轨道数依次增多
B.在同一能级上运动的电子,其能量一定相同
C.在同一能级上运动的电子,其运动状态有可能相同
D.在同一原子中,1s、2s、3s、4s……能级的原子轨道的平均半径相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业是我国化工生产支柱产业。主要生产工艺流程如下:

接触室中的反应为2SO2(g)+O2(g)![]() 2SO3(g) H=197 kJ·mol1。
2SO3(g) H=197 kJ·mol1。
请回答以下几个问题:
(1)图中炉气要净化的原因是_____________________________________。
(2)吸收塔排出的尾气先用足量的氨水吸收,反应的离子方程式为_______________,再用浓硫酸处理,得到较高浓度的SO2和铵盐。所得的SO2可用于工业制溴过程中吸收潮湿空气中的Br2,吸收Br2的过程中主要反应的化学方程式是____________________________________。所得铵盐溶液中各离子物质的量浓度由大到小的顺序为________________________。
(3)为什么从接触室出来的SO3气体不用水直接吸收,而是用98.3%的浓硫酸吸收:____________________。
![]() (4)燃烧1 t含二硫化亚铁90%的黄铁矿,在理论上能生产________t 98%的硫酸(设有1.5%的硫留在炉渣里,精确至0.01),从提高SO3的产率同时适当降低生产成本的角度出发,以下措施可取的是___________(填字母)。
(4)燃烧1 t含二硫化亚铁90%的黄铁矿,在理论上能生产________t 98%的硫酸(设有1.5%的硫留在炉渣里,精确至0.01),从提高SO3的产率同时适当降低生产成本的角度出发,以下措施可取的是___________(填字母)。
A.通入过量的空气 B.使用优质催化剂
C.调整适宜的温度 D.采用高压
(5)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图。为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,甲同学设计了如图实验:

现称取研细的黄铜矿样品1.84 g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的![]() 置于锥形瓶中,用0.05 mol·L-1 标准碘溶液进行滴定,消耗标准溶液20 mL。
置于锥形瓶中,用0.05 mol·L-1 标准碘溶液进行滴定,消耗标准溶液20 mL。
请回答下列问题:
(1)将样品研细后再反应,其目的是__________________________________。
(2)装置a和c的作用分别是________和________(填标号,可以多选)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)滴定达终点时的现象是_________________________________________。
(4)上述反应结束后,仍需通一段时间的空气,其目的是_______________________。
(5)通过计算可知,该黄铜矿的纯度为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com