
【题目】硫酸工业是我国化工生产支柱产业。主要生产工艺流程如下:

接触室中的反应为2SO2(g)+O2(g)![]() 2SO3(g) H=197 kJ·mol1。
2SO3(g) H=197 kJ·mol1。
请回答以下几个问题:
(1)图中炉气要净化的原因是_____________________________________。
(2)吸收塔排出的尾气先用足量的氨水吸收,反应的离子方程式为_______________,再用浓硫酸处理,得到较高浓度的SO2和铵盐。所得的SO2可用于工业制溴过程中吸收潮湿空气中的Br2,吸收Br2的过程中主要反应的化学方程式是____________________________________。所得铵盐溶液中各离子物质的量浓度由大到小的顺序为________________________。
(3)为什么从接触室出来的SO3气体不用水直接吸收,而是用98.3%的浓硫酸吸收:____________________。
![]() (4)燃烧1 t含二硫化亚铁90%的黄铁矿,在理论上能生产________t 98%的硫酸(设有1.5%的硫留在炉渣里,精确至0.01),从提高SO3的产率同时适当降低生产成本的角度出发,以下措施可取的是___________(填字母)。
(4)燃烧1 t含二硫化亚铁90%的黄铁矿,在理论上能生产________t 98%的硫酸(设有1.5%的硫留在炉渣里,精确至0.01),从提高SO3的产率同时适当降低生产成本的角度出发,以下措施可取的是___________(填字母)。
A.通入过量的空气 B.使用优质催化剂
C.调整适宜的温度 D.采用高压
(5)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图。为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为__________。

【答案】(1)防止接触室内催化剂中毒(1分)
(2)2NH3·H2O+SO22![]() +
+![]() +H2O(2分)
+H2O(2分)
SO2+Br2+2H2OH2SO4+2HBr(1分) c(![]() )>c(
)>c(![]() )>c(H+)>c(OH)(2分)
)>c(H+)>c(OH)(2分)
(3)用水吸收三氧化硫产生大量酸雾,从而阻止了三氧化硫的充分吸收(2分)
(4)1.48(2分) ABC(2分)
(5)16∶29(2分)
【解析】(1)从沸腾炉出来的炉气含有水蒸气、矿尘和杂质气体,净化的目的是防止催化剂中毒。
(2)足量的氨水吸收二氧化硫生成正盐,所以反应的离子方程式是2NH3·H2O+SO22![]() +
+![]() +H2O,SO2吸收潮湿空气中的Br2生成硫酸和氢溴酸:SO2+Br2+2H2OH2SO4+2HBr。得到的铵盐为硫酸铵,溶液中铵根离子水解显酸性,溶液中离子浓度大小为:c(
+H2O,SO2吸收潮湿空气中的Br2生成硫酸和氢溴酸:SO2+Br2+2H2OH2SO4+2HBr。得到的铵盐为硫酸铵,溶液中铵根离子水解显酸性,溶液中离子浓度大小为:c(![]() )>c(
)>c(![]() )>c(H+) > c(OH)。
)>c(H+) > c(OH)。
(3)用水吸收三氧化硫产生大量酸雾,从而阻止了三氧化硫的充分吸收。
(4)设能生成98%的硫酸x t,由工业生产硫酸的反应方程式可得下列关系式:
FeS2 → 2SO2 → 2SO3 → 2H2SO4
120 2×98
1 t×90%×(11.5%) x t×98%
解得x=1.48。
从提高SO3的产率同时适当降低生产成本的角度出发,可采取的措施应是A、B、C三个选项,D项不可取。因为此反应在400~500℃和催化剂的作用下,能较快地转化为三氧化硫,缩短达到平衡所需的时间;但此反应在常压下SO2的平衡转化率已经很高(达90%以上),若采用加压,会提高生产的成本。
(5)发生反应的方程式为2SO2+O2+2H2O2H2SO4,设通入SO2与水的质量比为x∶y,则反应后生成的H2SO4与H2O的质量比一定为1∶1,则 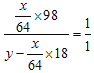 ,整理得
,整理得![]() 。
。


 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种典型的强氧化剂。
完成下列填空:
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO4-+ Cu2S + H+→ Cu2+ + SO2↑ + Mn2++ H2O(未配平)
② MnO4-+ CuS + H+ → Cu2+ + SO2↑ + Mn2++ H2O(未配平)
(1)下列关于反应①的说法中错误的是 (选填编号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8:5
c.生成2.24 L(标况下) SO2,转移电子的物质的量是0.8 mol
d.还原性的强弱关系是: Mn2+> Cu2S
(2)标出反应②中电子转移的方向和数目: MnO4-+ CuS
Ⅱ.在稀硫酸中,MnO4-和H2O2也能发生氧化还原反应
氧化反应:H2O2-2e → 2H++ O2↑
还原反应:MnO4- + 5e + 8H+→ Mn2++ 4H2O
(3)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为 。由上述反应得出的物质氧化性强弱的结论是 >___________(填写化学式)。
(4)已知:2KMnO4+ 7H2O2+3H2SO4→ K2SO4+2MnSO4+6O2↑+10H2O,则被1mol KMnO4氧化的H2O2是
mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2![]() 2NH3。该可逆反应达到平衡的标志是________________。
2NH3。该可逆反应达到平衡的标志是________________。
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
E.a molN≡N键断裂的同时,有6amolN—H键断裂
F.N2、H2、NH3的分子数之比为1∶3∶2
(2)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25min时,以N2表示的平均反应速率= ;该温度下平衡常数K= ;
(3) 利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H=-99kJ·mol-1
CH3OH(g) △H=-99kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H
CO(g)+H2O(g) △H
图1中能正确反映平衡常数K随温度变化关系的曲线是 ;反应③的△H= kJ·mol-1。
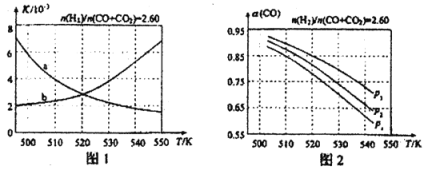
(4)合成气的组成n(2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图2所示。图中的压强p1、p2、p3由大到小的顺序为 ;α(CO)随温度升高而减小,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法中,正确的一组是
①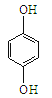 和
和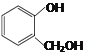 互为同系物
互为同系物
②蛋白质水解和油脂皂化都是高分子生成小分子的过程
③高分子材料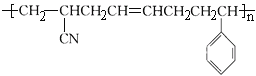 是由三种单体聚合而成的,该高分子材料是体型结构高分子,具有热固性
是由三种单体聚合而成的,该高分子材料是体型结构高分子,具有热固性
④C2H2 和C6H6不论二者以何种比例混合,只要总质量一定,则完全燃烧时消耗O2和生成的H2O的质量不变
⑤塑料、合成橡胶和合成纤维都是合成高分子材料
⑥棉花、蚕丝、人造丝的主要成分都是纤维素
A. ②③④⑤ B. ①③⑤ C. ④⑤ D. ①③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 石灰乳与过量碳酸氢钙溶液反应:HCO+Ca2++OH-===CaCO3↓+H2O
B. 向沸水中滴加饱和的FeCl3溶液制备Fe(OH)3胶体:
FeCl3+3H2O(沸水)![]() Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
C. 氢氧化铜与稀硫酸反应:H++OH-===H2O
D. 碳酸氢钠溶液中加入盐酸:CO32-+2H+===CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上真空炼铷的原理为2RbCl+Mg ![]() MgCl2+2Rb(g),下列说法正确的是
MgCl2+2Rb(g),下列说法正确的是
A. 镁的金属活动性比铷强,故镁可置换铷
B. 铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C. MgCl2的热稳定性比RbCl弱
D. Rb单质比RbCl更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电离平衡常数(K)的说法中正确的是
A. 在一定温度,相同浓度时电离平衡常数(K)越大可以表示弱电解质电离程度越大
B. 电离平衡常数(K)与温度无关
C. 不同浓度的同一弱电解质,其电离平衡常数(K)不同
D. 多元弱酸各步电离平衡常数相互关系为K1<K2<K3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如下图所示的转化。

试回答下列问题:
⑴ A的化学式是____________;
⑵ 反应F→D的化学方程式是______________________________________。
⑶ 检验F中金属阳离子的常用方法是___________________________________。
⑷ 物质B与盐酸反应的离子方程式是_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com