
【题目】工业上真空炼铷的原理为2RbCl+Mg![]() MgCl2+2Rb(g),下列说法正确的是( )
MgCl2+2Rb(g),下列说法正确的是( )
A.镁的金属活动性比铷强,故镁可置换铷
B.铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C.MgCl2的热稳定性比RbCl弱
D.Rb单质比RbCl更稳定
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】⑴氯碱工业是以惰性电极电解饱和食盐水,制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
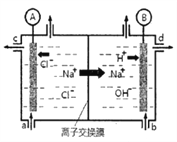
完成下列填空:
①离子交换膜的作用为:____________________。
②写出电解饱和食盐水的离子方程式_________。
③氢氧化钠溶液从图中_____位置流出。(选填a、b、c或d)
⑵电化学在日常生活中用途广泛,图①是镁次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O===Cl-+Mg(OH)2↓,图②是Cr2O![]() 的工业废水的处理,下列说法正确的是(____)
的工业废水的处理,下列说法正确的是(____)
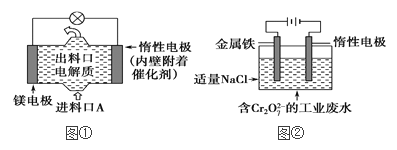
A.图②中Cr2O![]() 离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B.图②的电解池中,有0.084 g阳极材料参与反应,阴极会有33.6 mL的气体产生
C.图①中发生的还原反应是:Mg2++ClO-+H2O+2e-===Cl-+Mg(OH)2
D.若图①中3.6 g镁溶解产生的电量用以图②废水处理,理论可产生10.7 g氢氧化铁沉淀
⑶观察下列装置,回答下列问题:
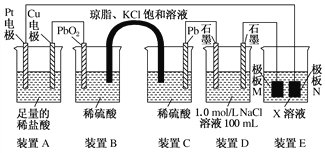
①装置B中PbO2上发生的电极反应方程式为_____________________________________。
②装置A中总反应的离子方程式为_____________________________________________。
③当装置A中Cu电极质量改变6.4 g时,装置D中产生的气体体积为________ L(标准状况下,不考虑气体的溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得。
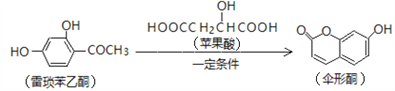
下列说法中正确的是
A. 1mol雷琐苯乙酮最多能与3mol Br2发生取代反应
B. 苹果酸能形成一种缩聚产物是![]()
C. 1mol伞形酮与足量NaOH溶液反应,最多可消耗2mol NaOH
D. 雷琐苯乙酮、苹果酸、伞形酮都能跟FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:

已知:RX![]() ROH;RCHO+CH3COOR’
ROH;RCHO+CH3COOR’![]() RCH=CHCOOR’ 请回答:
RCH=CHCOOR’ 请回答:
(1) A中官能团的名称是______________________。
(2) D→E的化学方程式________________________________________________。
(3) X的结构简式_________________。
(4)与F互为同分异构体又满足下列条件的有_______种。
①遇到氯化铁溶液会显紫色,②会发生银镜反应 ③苯环上有三个取代基
在其它同分异构体中核磁共振氢谱有六组峰,氢原子数比符合1:2:2:2:2:1的结构为_____。
(5)根据上面合成信息及试剂,写出以乙烯为原料(无机试剂任选),写出合成CH3CH=CHCOOCH2CH3路线。_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位。请回答下列问题:
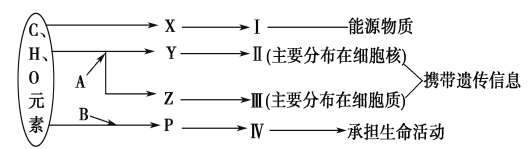
(1)图中X是________,I在小麦种子中主要是指______________。
(2)图中Z是________,使用甲基绿、派洛宁(吡罗红)混合染液染色,可使Ⅲ呈现________色。
(3)图中P的结构通式为________;写出由P形成Ⅳ的结构层次______________。
(4)Ⅲ和Ⅳ两者都有多样性,两者多样性的关系是前者________后者。
(5)构成细胞的化合物中,随着年龄增长明显减少的主要是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】因在航空、核能、电池等高技术领域的重要作用——锂被称为“21世纪的能源金属”。完成下列填空:
(1)锂位于元素周期表的________。锂的很多化学性质与镁相似,请依据元素周期律进行解释:_________。
(2)氢化锂(LiH)是离子化合物,写出其阴离子的电子式_______________,LiH中阴离子半径大于阳离子半径,其原因是__________________________________________________。
(3) 工业上用Li2CO3制取锂的化合物及金属锂。碳原子核外电子有________种不同能量的电子,其中有两个电子的能量最高且能量相等,这两个电子所处的轨道是_____________________。
(4)用Li2CO3、氨水和液溴制备LiBr·H2O的流程如下:

①合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:
Li2CO3+Br2+ NH3·H2O→LiBr+(___) __________。
②溴化锂的溶解度随温度变化曲线如图所示,请补全从溶液中得到LiBr·H2O晶体的实验步骤:_____、过滤、用乙醇洗涤,干燥。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、L为五种短周期元素,非金属元素X最外层电子数与其周期序数相同,Y的最外层电子数是其所在周期数的2倍。Y在Z中充分燃烧能生成其最高价化合物YZ2。W+与Z2-具有相同的电子数。X在L中燃烧,产物XL溶于水得到一种强酸。请回答下列问题:
(1)X在周期表中的位置是_____。请写出实验室制备单质L的化学方程式______,尾气处理的离子方程式____________。
(2)由X分别与Y、Z形成的最简单化合物的稳定性关系为___________________。
(3)由X、Y、Z、W组成的一种盐,在面食中有大量使用,在其水溶液中滴入由X、Y、Z形成的厨房中常见的一种酸,反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是()

A. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
B. 每生成2 mol AB(g)吸收b kJ能量
C. 该反应中反应物的总能量高于生成物的总能量
D. 该反应热ΔH=(a-b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.1mol/L、体积为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg(V/ V0)的变化关系如图所示。下列叙述正确的是( )

A. HX、HY都是弱酸,且HX的酸性比HY的弱
B. 相同温度下,电离常数K(HX):a>b
C. 常温下,由水电离出的c(H+)·c(OH-):a<b
D. lg(V/ V0)=3,若同时微热两种溶液,则[c(X-)/c(Y-)]减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com