
【题目】浓度均为0.1mol/L、体积为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg(V/ V0)的变化关系如图所示。下列叙述正确的是( )

A. HX、HY都是弱酸,且HX的酸性比HY的弱
B. 相同温度下,电离常数K(HX):a>b
C. 常温下,由水电离出的c(H+)·c(OH-):a<b
D. lg(V/ V0)=3,若同时微热两种溶液,则[c(X-)/c(Y-)]减小
 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】工业上真空炼铷的原理为2RbCl+Mg![]() MgCl2+2Rb(g),下列说法正确的是( )
MgCl2+2Rb(g),下列说法正确的是( )
A.镁的金属活动性比铷强,故镁可置换铷
B.铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C.MgCl2的热稳定性比RbCl弱
D.Rb单质比RbCl更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表前四周期的一部分,下列是有关R、W、X、Y、Z五种元素的叙述,其中正确的是
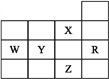
A. X元素是电负性最大的元素
B. p能级未成对电子最多的是Z元素
C. Y、Z的阴离子电子层结构都与R原子的相同
D. W元素的第一电离能小于Y元素的第一电离能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅、铜、镓、硒等化学物质可作为制造太阳能电池板的材料。
(1)镓是ⅢA族元素,写出基态镓原子的核外电子排布式__________________。
(2)硒为第四周期ⅥA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由大到小的顺序为______________(用元素符号表示)。
(3)SeO3分子的立体构型为____,与硒同主族元素的氢化物(化学式为H2R)中,沸点最低的物质化学式为____。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的关系如图所示,呈现这种变化的原因是____________。

(5)金属铜投入氨水中或投入过氧化氢溶液中均无明显现象,但投入氨水与过氧化氢的混合液中,则铜片溶解,溶液呈深蓝色,写出使溶液呈深蓝色的离子的化学式_____。
(6)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数之比为____________,若该晶体的晶胞边长为a pm,则该合金的密度为________________g·cm-3(列出计算式,不要求计算结果,设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
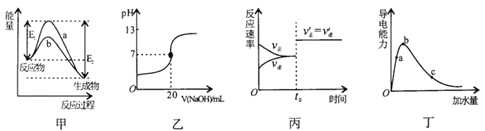
A. 图甲表示某吸热反应在无催化剂(a)和有催化剂(b)时反应的能量变化
B. 图乙表示常温下,0.1mol/LNaOH溶液滴定20.00mL0.1mol/L醋酸溶液的滴定曲线
C. 图丙表示某可逆反应的反应速率随时间的变化关系,t0时刻改变的条件是使用了催化剂
D. 图丁表示一定质量冰醋酸加水稀释过程中、溶液导电能力变化曲线,且醋酸电离程度:a<b<c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列括号中的物质为杂质,请写出除杂的离子方程式。
(1)![]() ;离子方程式为____________________________________。
;离子方程式为____________________________________。
(2)![]() :离子方程式为____________________________________。
:离子方程式为____________________________________。
(3)![]() :离子方程式为____________________________________。
:离子方程式为____________________________________。
(4)![]() :离子方程式为____________________________________。
:离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块金属钠投入到滴有紫色石蕊试液的盛冷水的烧杯中,甲同学认为可观察到下列现象,其中正确的有( )
①钠投入水中,先沉入水底,后浮出水面
②钠立即与水反应,并有气体产生
③反应后溶液变红
④钠熔成闪亮的小球
⑤小球在水面上四处游动
⑥有“嘶嘶”的响声发出
A. ①②③④ B. ②③④⑤
C. ②④⑤⑥ D. ③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,亚砷酸(H3AsO3)水溶液中含砷的各物种的分布分数(平衡时某物种的物质的量浓度占各物种的物质的量浓度之和的分数)与pH的关系如图所示。下列说祛正确的是

A. 以酚酞为指示剂,用NaOH溶液滴定到终点时发生的主要反应为H3AsO3+2OH-==HasO32-+H2O
B. pH=11时,溶液中有c(H2AsO3-)+2c(HAsO32-)+c(OH-)=c(H+)
C. 若将亚砷酸溶液加水稀释,则稀释过程中c(HAsO32-)/ c(H2AsO3-)减小
D. Ka1(H3AsO3)的数量级为10-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 硅晶体中,有NA个Si就有2 NA个Si—Si键
B. 常温常压下,等物质的量浓度的Na2CO3与Na2S溶液中Na+数目相等
C. 惰性电极电解食盐水,若线路中通过2 NA个电子的电量时,则阳极产生气体22.4 L
D. 标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com