
【题目】常温下,亚砷酸(H3AsO3)水溶液中含砷的各物种的分布分数(平衡时某物种的物质的量浓度占各物种的物质的量浓度之和的分数)与pH的关系如图所示。下列说祛正确的是

A. 以酚酞为指示剂,用NaOH溶液滴定到终点时发生的主要反应为H3AsO3+2OH-==HasO32-+H2O
B. pH=11时,溶液中有c(H2AsO3-)+2c(HAsO32-)+c(OH-)=c(H+)
C. 若将亚砷酸溶液加水稀释,则稀释过程中c(HAsO32-)/ c(H2AsO3-)减小
D. Ka1(H3AsO3)的数量级为10-10
【答案】D
【解析】根据图知,碱性条件下H3AsO3的浓度减小、H2AsO3-浓度增大,说明碱和H3AsO3生成H2AsO3-,该反应为酸碱的中和反应,同时还生成水,离子方程式为OH-+H3AsO3=H2AsO3-+H2O,A错误;pH=11时,形成NaH2AsO3和Na2HAsO3混合液,溶液中存在的电荷守恒关系为:3 c(AsO33-)+
c(H2AsO3-)+2c(HAsO32-)+c(OH-)=c(H+)+ c(Na+),B错误;
若将亚砷酸溶液加水稀释,电离平衡向右移动,由二级电离方程式可知,n(HAsO32-)增大, n(H2AsO3-)减小,则c(HAsO32-)/ c(H2AsO3-)增大,C错误;
依据图象中H3AsO3和H2AsO3-浓度相同时的PH=9.2,H3AsO3H++H2AsO3-,K a1(H3AsO3)= ![]() =c(H+)=10-9.2.mol/L,D正确。
=c(H+)=10-9.2.mol/L,D正确。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是()

A. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
B. 每生成2 mol AB(g)吸收b kJ能量
C. 该反应中反应物的总能量高于生成物的总能量
D. 该反应热ΔH=(a-b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.1mol/L、体积为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg(V/ V0)的变化关系如图所示。下列叙述正确的是( )

A. HX、HY都是弱酸,且HX的酸性比HY的弱
B. 相同温度下,电离常数K(HX):a>b
C. 常温下,由水电离出的c(H+)·c(OH-):a<b
D. lg(V/ V0)=3,若同时微热两种溶液,则[c(X-)/c(Y-)]减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是
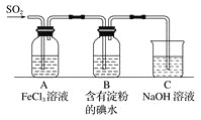
A. 能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B. 装置C的作用是吸收SO2尾气,防止污染空气
C. 为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
D. 为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
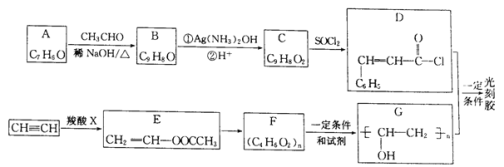
【题目】光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂和产物略去):
已知; 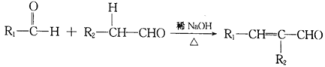 (R1、R2为烃基或氢)
(R1、R2为烃基或氢)
(1)A的名称为________;羧酸X的结构简式为___________________。
(2)C可与乙醇发生酯化反应,其化学方程式为____________,反应中乙醇分子所断裂的化学键是____________(填选项字母)。
aC——C键 b.C——H键 c.O——H键 d.C——O键
(3)E→F的化学方程式为___________;F到G的反应类型为_______________。
(4)写出满足下列条件B的2种同分异构体:___________、____________________。
①分子中含有苯环;②能发生银镜反应;③核磁共振氢谱峰面积比为2:2:2:1:1。
(5)根据已有知识并结合相关信息,写出以CH3CHO为原料制备CH3COCOCOOH的合成路线流程图(无机试剂任用):___________________________。合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学-物质结构与性质)氮及其化合物广泛存在于自然界中,回答下列问题:
(1)在基态15N原子的p能级上存在_____个自旋方向相同的电子;CN—中σ键与π键数目之比为_____。
(2)碱性肥料氰氨化钙(CaCN2)的组成元素中第一电离能最小的是_______(填名称)。
(3)化合物(CH3)3N能溶于水,其原因是____________________________________,(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键类型为_______________。
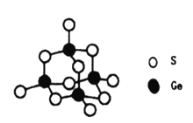
(4)阳离子[(CH3)3NH]+和阴离子A按个数比4:1组成化合物,阴离子A的结构如下图所示,则s原子的杂化轨道类型是__________,阴离子A的化学式为_______________。
(5)立方氮化硼晶胞如下图所示(白球为氮原子,黑球为硼原子),则硼原子的配位数为___;若晶胞边长为acm,则立方氮化硼的密度是______g·cm-3(只要求列算式,阿伏加德罗常数用NA表示)。
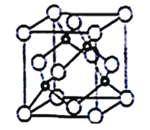
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,将1mLpH=1的H2SO4溶液加水稀释到100mL,稀释后的溶液中 =_________。
=_________。
(2)某温度时,测得0.01mol·L-1的NaOH溶液的pH 为11,则该温度下水的离子积常数Kw=_________。该温度_________(填“高于“或“低于")25℃。
(3)常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为c2,则![]() =_________。
=_________。
(4)常温下,pH=13的Ba(OH)2溶液aL与pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计),若所得混合溶液呈中性,则a∶b=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化合物CH2=C(CH3)COOCH2CH2OH 的说法不正确是( )
A. 能发生加成、取代和消去反应 B. 存在顺反异构体
C. 能使酸性高锰酸钾溶液褪色 D. 能和NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置。电极I为Al,其他电极均为Cu,则( )

A. 电极I发生还原反应 B. 电极II逐渐溶解
C. 电流方向:电极IV―→![]() ―→电极I D. 电极III的电极反应:Cu2++2e-=Cu
―→电极I D. 电极III的电极反应:Cu2++2e-=Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com