
【题目】(化学-物质结构与性质)氮及其化合物广泛存在于自然界中,回答下列问题:
(1)在基态15N原子的p能级上存在_____个自旋方向相同的电子;CN—中σ键与π键数目之比为_____。
(2)碱性肥料氰氨化钙(CaCN2)的组成元素中第一电离能最小的是_______(填名称)。
(3)化合物(CH3)3N能溶于水,其原因是____________________________________,(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键类型为_______________。
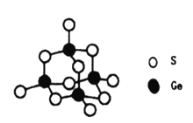
(4)阳离子[(CH3)3NH]+和阴离子A按个数比4:1组成化合物,阴离子A的结构如下图所示,则s原子的杂化轨道类型是__________,阴离子A的化学式为_______________。
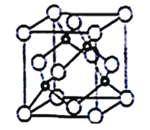
(5)立方氮化硼晶胞如下图所示(白球为氮原子,黑球为硼原子),则硼原子的配位数为___;若晶胞边长为acm,则立方氮化硼的密度是______g·cm-3(只要求列算式,阿伏加德罗常数用NA表示)。
【答案】3 1:2 钙 (CH3)3N为极性分子且能与水分子形成氢键 配位键 sp3 [Ge4S10]4- 4 100/(a3NA)
【解析】
(1)S电子云的形状为球形;N原子的电子排布式为1s22s22p3,轨道表示式为:![]() ,则p能级轨道上存在3个自旋方向相同的电子;CN-与N2为原子个数和价电子数相同的等电子体,等电子体具有相同的结构,氮气中存在氮氮三键,则CN-离子中存在碳氮三键,则离子中σ键与π键数目之比为1:2;
,则p能级轨道上存在3个自旋方向相同的电子;CN-与N2为原子个数和价电子数相同的等电子体,等电子体具有相同的结构,氮气中存在氮氮三键,则CN-离子中存在碳氮三键,则离子中σ键与π键数目之比为1:2;
(2)由于非金属性N>C>Ca,故第一电离能Ca<C<N,则第一电离能最小的是钙;
(3)(CH3)3N为结构不对称的极性分子,分子中氮原子非金属性强,原子半径小,和水之间形成氢键,所以(CH3)3N在水中溶解性增强;化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为(CH3)3N中氮原子与氢离子形成配位键;
(4)S原子的最外层电子数为6,由图可知S原子形成2个共价键,则阴离子A中S原子含有2个成键电子对和2个孤电子对,即其价层电子对数为4,属于sp3杂化;阴离子A中含有4个Ge和10个S,其中4个S只形成一个共价键,则还要得到一个电子才能形成8电子稳定结构,则A离子带有4个负电荷,即离子的化学式为[Ge4S10]4-;
(5)晶胞中N原子位于顶点和面心上,则原子数目=8×![]() +6×
+6×![]() =4,B原子位于晶胞内,则原子数目为4,故氮化硼的化学式为BN;由晶胞结构可知,B原子位于4个N原子形成的四面体的中心位置,故B原子填充N原子的正四面体空隙;晶胞的质量=
=4,B原子位于晶胞内,则原子数目为4,故氮化硼的化学式为BN;由晶胞结构可知,B原子位于4个N原子形成的四面体的中心位置,故B原子填充N原子的正四面体空隙;晶胞的质量= ![]() ,晶胞的体积为a3cm3,根据晶胞密度ρ=
,晶胞的体积为a3cm3,根据晶胞密度ρ=  。
。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】在加热条件下,用二氧化锰与足量浓盐酸反应,制得氯气0.56L(标准状况)。问:
(1)理论上需要消耗MnO2的质量为__________。
(2)被氧化的HCl的物质的量是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列括号中的物质为杂质,请写出除杂的离子方程式。
(1)![]() ;离子方程式为____________________________________。
;离子方程式为____________________________________。
(2)![]() :离子方程式为____________________________________。
:离子方程式为____________________________________。
(3)![]() :离子方程式为____________________________________。
:离子方程式为____________________________________。
(4)![]() :离子方程式为____________________________________。
:离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铟和砷化铟纳米晶具备独特的光学和电学特性,广泛应用于生物医学、通信、太阳能电池等领域。回答下列问题:
(1)基态磷原子电子排布式为____________;基态As原子中未成对电子数为__________。
(2)PH3分子空间构型为_______;AsO33-中As原子的杂化方式为____________。
(3)AsH3与NH3在水中溶解度较大的是________,其原因是_________________。
(4)酞菁铟是有机分子酞菁与金属铟形成的复杂分子,结构简式如下图I所示,该分子中存在的化学键为___(填选项字母)。

(5)砷化铟的晶胞绐构如上图II所示,砷化铟晶体的化学式为_______________;该晶胞的棱长为acm,则砷化铟晶体的密度为__________(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,亚砷酸(H3AsO3)水溶液中含砷的各物种的分布分数(平衡时某物种的物质的量浓度占各物种的物质的量浓度之和的分数)与pH的关系如图所示。下列说祛正确的是

A. 以酚酞为指示剂,用NaOH溶液滴定到终点时发生的主要反应为H3AsO3+2OH-==HasO32-+H2O
B. pH=11时,溶液中有c(H2AsO3-)+2c(HAsO32-)+c(OH-)=c(H+)
C. 若将亚砷酸溶液加水稀释,则稀释过程中c(HAsO32-)/ c(H2AsO3-)减小
D. Ka1(H3AsO3)的数量级为10-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性。充电时右槽溶液颜色由绿色变为紫色。下列叙述正确的是

A. 放电时,H+从左槽迁移进右槽
B. 放电过程中,左槽溶液颜色由黄色变为蓝色
C. 充电时,b极接直流电源正极,a极接直流电源负极
D. 充电过程中,a极的电极反应式为:VO2++2H++e- = VO2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中不正确的个数是
①铝在空气中很容易燃烧
②明矾在水中能生成Al(OH)3胶体,可用作净水剂
③含硅4%的钢具有良好的导磁性,可用来制造变压器铁芯
④滴有酚酞溶液的水中加Na2O2,溶液变红
⑤取等量的两瓶失去标签的Na2CO3和NaHCO3无色饱和溶液于两支试管中,滴加Ba(OH)2溶液, 生成白色沉淀的是Na2CO3溶液
⑥铁红是磁性氧化铁,常用作红色油漆和涂料
⑦铁与水蒸气在高温下的反应产物为Fe2O3和H2
A. 2个 B. 3个 C. 4个 D. 5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的总反应:3Fe2++2S2O32—+O2+x M===Fe3O4+S4O62—+2H2O,有关说法正确的是 ( )
A. 每转移3mol电子,有1.5mol Fe2+被氧化
B. M为OH—离子,x=2
C. O2、S2O32—都是氧化剂
D. 每生成1molFe3O4,反应中转移2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶有“金属味精”之称。以天青石(主要含有SrSO4和少量CaCO3、MgO杂质)生产氢氧化锶的工艺如下:

已知氢氧化锶在水中的溶解度:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
溶解度(g/100mL) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(1)隔绝空气焙烧时SrSO4只被还原成SrS,化学方程式为____。
(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12。
①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=____。
②若pH过大,将导致氢氧化锶的产率降低,请解释原因____。
(3)“趁热过滤”的目的是____,“滤渣”的主要成分为___。
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为____、过滤、洗涤、干燥。
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,吸收时的氧化产物为___(填化学式);再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com