
【题目】某同学组装了如图所示的电化学装置。电极I为Al,其他电极均为Cu,则( )

A. 电极I发生还原反应 B. 电极II逐渐溶解
C. 电流方向:电极IV―→![]() ―→电极I D. 电极III的电极反应:Cu2++2e-=Cu
―→电极I D. 电极III的电极反应:Cu2++2e-=Cu
【答案】C
【解析】
根据图示判断左边两池通过盐桥构成原电池,产生电流对右边硫酸铜溶液进行电解(相当于精炼铜),电极I为负极,电极II为正极,与负极相连的电极Ⅳ为电解池的阴极,与正极相连的电极Ⅲ为电解池的阳极。
A、根据分析可知,I为负极,失去电子,发生氧化反应。故A错误;B、电极II为正极,电解质溶液中的铜离子在正极得到电子生成铜单质,电极II有铜析出,故B错误;C、根据分析可知,电极I为负极,电极II为正极,与负极相连的电极Ⅳ为电解池的阴极,与正极相连的电极Ⅲ为电解池的阳极。所以电流方向:电极IV―→![]() ―→电极I,故C正确;D、电极III为阳极,电极反应为:Cu -2e-= Cu2+,故D正确;故选C。
―→电极I,故C正确;D、电极III为阳极,电极反应为:Cu -2e-= Cu2+,故D正确;故选C。


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】常温下,亚砷酸(H3AsO3)水溶液中含砷的各物种的分布分数(平衡时某物种的物质的量浓度占各物种的物质的量浓度之和的分数)与pH的关系如图所示。下列说祛正确的是

A. 以酚酞为指示剂,用NaOH溶液滴定到终点时发生的主要反应为H3AsO3+2OH-==HasO32-+H2O
B. pH=11时,溶液中有c(H2AsO3-)+2c(HAsO32-)+c(OH-)=c(H+)
C. 若将亚砷酸溶液加水稀释,则稀释过程中c(HAsO32-)/ c(H2AsO3-)减小
D. Ka1(H3AsO3)的数量级为10-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 硅晶体中,有NA个Si就有2 NA个Si—Si键
B. 常温常压下,等物质的量浓度的Na2CO3与Na2S溶液中Na+数目相等
C. 惰性电极电解食盐水,若线路中通过2 NA个电子的电量时,则阳极产生气体22.4 L
D. 标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)高铁酸钾![]() 是一种新型、高效、多功能水处理剂。某学习小组设计如下方案制备高铁酸钾:
是一种新型、高效、多功能水处理剂。某学习小组设计如下方案制备高铁酸钾:
![]()
①高铁酸钾中铁元素的化合价为________,据此推测它具有的化学性质是____________。
②其中第一步操作是:在NaClO溶液中加入烧碱固体形成强碱性环境,将研磨过的硝酸铁少量多次地加入上述溶液中,冰水浴中反应1 h。发生的离子反应为2Fe3++3ClO-+10OH-===2FeO![]() +3Cl-+5H2O,还原剂是_____________。
+3Cl-+5H2O,还原剂是_____________。
③高铁酸钾和水发生反应,生成物能吸附杂质净水,同时还产生气体,写出反应的离子方程式:___________________。
(2)某Fe 2(SO4) 3样品含有少量FeSO4杂质,为了测定该样品中铁元素的含量,设计如下实验:
Ⅰ.称取样品m g,加入稀H2SO4,后加水配制成250.00 mL溶液;
Ⅱ.取25.00 mL溶液,先加入![]() ,然后再加过量的氨水,过滤;
,然后再加过量的氨水,过滤;
Ⅲ.将沉淀用蒸馏水洗涤数次后,烘干;
Ⅳ.灼烧至质量不再减少为止,得到红棕色固体,冷却后称量,质量为n g。
请根据上面操作流程,回答以下问题:
①步骤Ⅰ中称量使用的仪器是________________,配制用到的仪器有烧杯、玻璃棒、胶头滴管,还要补充的玻璃仪器是____________________。
②步骤Ⅱ中过滤用的仪器有滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是_________;加入![]() 的主要目的是________________。
的主要目的是________________。
③步骤Ⅲ中检验该沉淀已经洗涤干净的操作是________________。
④若要检验溶液中的![]() ,则应该加入________________试剂。
,则应该加入________________试剂。
⑤计算该样品中铁元素的质量分数的表达式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是向MgCl2、AlCl3混合溶液中,开始滴加试剂A,之后改滴试剂B,所得沉淀ymol 与试剂体积V(mL)间的关系。请回答
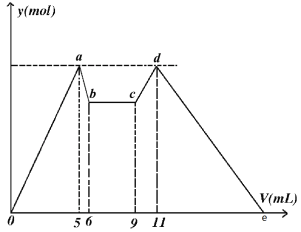
(1)写出c~d段发生反应的离子方程式______________________________________
(2)原溶液中Mg2+、Al3+、Cl的物质的量浓度之比为:_______________________
(3)如果A和B为一元强酸或一元强碱,则c(A):c(B)=_____________________
(4)图中e点处V=_______________(填数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶有“金属味精”之称。以天青石(主要含有SrSO4和少量CaCO3、MgO杂质)生产氢氧化锶的工艺如下:

已知氢氧化锶在水中的溶解度:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
溶解度(g/100mL) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(1)隔绝空气焙烧时SrSO4只被还原成SrS,化学方程式为____。
(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12。
①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=____。
②若pH过大,将导致氢氧化锶的产率降低,请解释原因____。
(3)“趁热过滤”的目的是____,“滤渣”的主要成分为___。
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为____、过滤、洗涤、干燥。
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,吸收时的氧化产物为___(填化学式);再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g),K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g),K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液里只含有下列7种离子中的某几种:Mg2+ 、H+ 、Ag+ 、Na+ 、Cl- 、HCO3- 、OH- 。已知:该溶液能跟金属铝反应,且放出氢气。试回答:
(1)若铝跟溶液反应后只有AlO2-生成,则原溶液一定含有的大量离子是_______ ,发生该反应的离子方程式是__________;还可能含有离子是__________。
(2)若铝跟溶液反应后只有Al3+生成,则原溶液中一定不能大量含有的离子是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com