
【题目】如图是向MgCl2、AlCl3混合溶液中,开始滴加试剂A,之后改滴试剂B,所得沉淀ymol 与试剂体积V(mL)间的关系。请回答
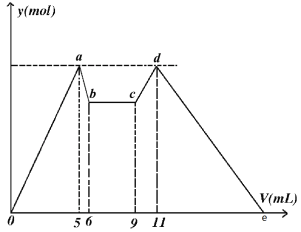
(1)写出c~d段发生反应的离子方程式______________________________________
(2)原溶液中Mg2+、Al3+、Cl的物质的量浓度之比为:_______________________
(3)如果A和B为一元强酸或一元强碱,则c(A):c(B)=_____________________
(4)图中e点处V=_______________(填数字)
【答案】AlO2-+ H++H2O= Al(OH)3↓ 1:1:5 2:1 21
【解析】
根据图像知,MgCl2、AlCl3混合溶液中,开始滴加试剂A,立即产生沉淀,说明A为碱,因为氢氧化铝不能溶于弱碱,因此A为强碱,如NaOH等;ab段应该是强碱溶解氢氧化铝,cd段为偏铝酸根与酸反应生成氢氧化铝沉淀,de段为氢氧化镁和氢氧化铝溶解于酸的过程,因此试剂B为强酸,如HCl等,bc段发生酸碱中和反应。据此分析解答。
(1)根据上述分析,c~d段为偏铝酸根与酸反应生成氢氧化铝沉淀,反应的离子方程式为AlO2-+ H++H2O= Al(OH)3↓,故答案为:AlO2-+ H++H2O= Al(OH)3↓;
(2)开始加入碱,生成沉淀与氢氧化铝溶解消耗碱的体积之比为5∶1,设溶解氢氧化铝消耗OH-为1mol,则生成沉淀最大时,消耗OH-为5mol,由Al(OH)3+OH-=AlO2-+2H2O,可知n[Al(OH)3]=n(OH-)=1mol,故n(Al3+)=n[Al(OH)3]=1mol,生成氢氧化铝沉淀消耗OH-为1mol×3=3mol,则生成氢氧化镁消耗OH-为5mol-3mol=2mol,故n[Mg(OH)2]=1mol,则n(Mg2+)=n[Mg(OH)2]=1mol,由电荷守恒可知n(Cl-)=3n(Al3+)+2n(Mg2+)=5mol,故原混合溶液中c(Mg2+)∶c(Al3+)∶c(Cl-)=1∶1∶5,故答案为:1∶1∶5
(3)如果A和B为一元强酸或一元强碱,由(2)中分析可知,溶解氢氧化铝消耗OH-为1mol,n(AlO2-)= n(Al3+)=1mol,由AlO2-+H++H2O=Al(OH)3↓,可知消耗n(H+)=1mol,根据图像,溶解氢氧化铝消耗一元强碱溶液体积与生成氢氧化铝沉淀消耗一元强酸溶液的体积之比为1∶2,则c(A)∶c(B)=2∶1,故答案为:2∶1;
(4)de段为氢氧化镁和氢氧化铝溶解于强酸的过程,由(2)中分析可知,d点含有1mol氢氧化铝和1mol氢氧化镁,溶解1mol氢氧化铝需要消耗3mol H+,溶解1mol氢氧化镁需要消耗2mol H+,因此de段消耗的酸与cd段消耗的酸的物质的量之比为1∶5,则de段消耗的酸与cd段消耗的酸的体积之比为1∶5,因此de段消耗的酸的体积为10mL,因此e点处V=21,故答案为:21。


科目:高中化学 来源: 题型:
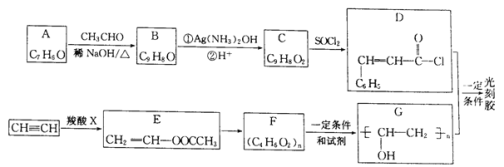
【题目】光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂和产物略去):
已知; 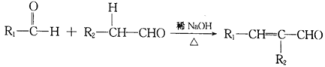 (R1、R2为烃基或氢)
(R1、R2为烃基或氢)
(1)A的名称为________;羧酸X的结构简式为___________________。
(2)C可与乙醇发生酯化反应,其化学方程式为____________,反应中乙醇分子所断裂的化学键是____________(填选项字母)。
aC——C键 b.C——H键 c.O——H键 d.C——O键
(3)E→F的化学方程式为___________;F到G的反应类型为_______________。
(4)写出满足下列条件B的2种同分异构体:___________、____________________。
①分子中含有苯环;②能发生银镜反应;③核磁共振氢谱峰面积比为2:2:2:1:1。
(5)根据已有知识并结合相关信息,写出以CH3CHO为原料制备CH3COCOCOOH的合成路线流程图(无机试剂任用):___________________________。合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(主要成分CuFeS2)是提取Cu的主要原料。
已知:2CuFeS2+4O2![]() Cu2S+3SO2+2FeO(Ⅰ)
Cu2S+3SO2+2FeO(Ⅰ)
产物Cu2S在1200 ℃高温下继续反应:2Cu2S+3O2==2Cu2O+2SO2 (Ⅱ)
2Cu2O+Cu2S==6Cu +SO2↑ (Ⅲ)
假定各步反应都完全。则下列说法正确的是
A. 反应Ⅰ中CuFeS2仅作还原剂
B. 取12.5g黄铜矿样品,经测定含3.60g硫,则矿样中CuFeS2质量分数一定为82.8%
C. 由6molCuFeS2生成6molCu消耗O2的物质的量为14.25mol
D. 6molCuFeS2和15.75molO2反应,理论上可得到铜的物质的量为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2可将正常的血红蛋白中的二价铁变为高铁血红蛋白中的三价铁,失去携氧能力。完成下列填空:
(1)N元素在元素周期表中位于第____族,N原子的结构示意图______________。
(2)Na、N、O三种元素形成的简单离子中,离子半径最小的是_______(用离子符号表示)。
(3)某工厂的废液中含有2%~5%的NaNO2直接排放会造成污染。下列试剂中,能使NaNO2转化为N2的是______________(选填编号)。
a.NaCl b.NH4Cl c.HNO3 d.H2SO4
(4)已知NaNO2能发生如下反应:NaNO2 + HI → NO↑+ I2 + NaI + H2O
①配平反应物的系数并标出电子转移的方向和数目__NaNO2 +__ HI → NO↑+ I2 + NaI + H2O 。
②当有0.75mol HI被氧化时,在标准状况下产生气体的体积是_______L。
(5)NaNO2外观与食盐相似,根据上述反应,可用于鉴别NaNO2和NaCl。现有 ①白酒、②碘化钾淀粉试纸、③淀粉、④白糖、⑤白醋,其中可选用的物质至少有______(选填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据某有机物的结构:
(1)测定实验式:某含碳、氢、氧三种元素的有机物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,则其实验式是________。
(2)确定分子式:下图是该有机物的质谱图,则其相对分子质量为______,分子式为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置。电极I为Al,其他电极均为Cu,则( )

A. 电极I发生还原反应 B. 电极II逐渐溶解
C. 电流方向:电极IV―→![]() ―→电极I D. 电极III的电极反应:Cu2++2e-=Cu
―→电极I D. 电极III的电极反应:Cu2++2e-=Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)为了证明NH3·H2O是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验。0.010mol·L-1氨水、0.1mol·L-1NH4Cl溶液、NH4Cl晶体、酚酞溶液、pH试纸、蒸馏水。
①甲用pH试纸测出0.010mol·L-1氨水的pH为10,则认定NH3·H2O是弱电解质,你认为这一方法________(填“正确”或“不正确”),并说明理由:__________________________________。
②乙取出10mL0.010mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1000mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b值应满足的关系是_____。
(II)(1)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=________。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是( )
A. pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol·L-1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的乙二酸(H2C2O4)溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
D. pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铜片放入0.1mol·L-1FeCl3溶液中,反应一段时间后取出铜片,溶液中![]() ,则反应后溶液中
,则反应后溶液中![]() 与
与![]() 的物质的量之比为 ( )
的物质的量之比为 ( )
A. 3:2 B. 3:4 C. 3:5 D. 4:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com