
【题目】下列配合物的配位数是6的是( )
A.K2[Co(SCN)4] B.Fe(SCN)3
C.Na3[AlF6] D.[Cu(NH3)4]Cl2
 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】(1)常温下,将1mLpH=1的H2SO4溶液加水稀释到100mL,稀释后的溶液中 =_________。
=_________。
(2)某温度时,测得0.01mol·L-1的NaOH溶液的pH 为11,则该温度下水的离子积常数Kw=_________。该温度_________(填“高于“或“低于")25℃。
(3)常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为c2,则![]() =_________。
=_________。
(4)常温下,pH=13的Ba(OH)2溶液aL与pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计),若所得混合溶液呈中性,则a∶b=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2可将正常的血红蛋白中的二价铁变为高铁血红蛋白中的三价铁,失去携氧能力。完成下列填空:
(1)N元素在元素周期表中位于第____族,N原子的结构示意图______________。
(2)Na、N、O三种元素形成的简单离子中,离子半径最小的是_______(用离子符号表示)。
(3)某工厂的废液中含有2%~5%的NaNO2直接排放会造成污染。下列试剂中,能使NaNO2转化为N2的是______________(选填编号)。
a.NaCl b.NH4Cl c.HNO3 d.H2SO4
(4)已知NaNO2能发生如下反应:NaNO2 + HI → NO↑+ I2 + NaI + H2O
①配平反应物的系数并标出电子转移的方向和数目__NaNO2 +__ HI → NO↑+ I2 + NaI + H2O 。
②当有0.75mol HI被氧化时,在标准状况下产生气体的体积是_______L。
(5)NaNO2外观与食盐相似,根据上述反应,可用于鉴别NaNO2和NaCl。现有 ①白酒、②碘化钾淀粉试纸、③淀粉、④白糖、⑤白醋,其中可选用的物质至少有______(选填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置。电极I为Al,其他电极均为Cu,则( )

A. 电极I发生还原反应 B. 电极II逐渐溶解
C. 电流方向:电极IV―→![]() ―→电极I D. 电极III的电极反应:Cu2++2e-=Cu
―→电极I D. 电极III的电极反应:Cu2++2e-=Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)为了证明NH3·H2O是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验。0.010mol·L-1氨水、0.1mol·L-1NH4Cl溶液、NH4Cl晶体、酚酞溶液、pH试纸、蒸馏水。
①甲用pH试纸测出0.010mol·L-1氨水的pH为10,则认定NH3·H2O是弱电解质,你认为这一方法________(填“正确”或“不正确”),并说明理由:__________________________________。
②乙取出10mL0.010mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1000mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b值应满足的关系是_____。
(II)(1)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=________。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C60具有完美的球形结构。之后Si60、N60球形分子被不断制备出来。回答下列问题:

(1)Si的核外电子排布式为___________,C和N元素中第一电离能较大的是___________。
(2)富勒烯衍生物具有良好的光电性能,富勒烯(C60)的结构如上图所示, C60属于________晶体;
(3)N60的晶体中存在的作用力有___________(填字母标号)。
A.共价键 B.离子键 C.氢键 D.范德华力 E.配位键 F.金属键
(4)氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子的构型为______形,阳离子中氮的杂化方式为_________。

(5)金属 M(相对原子质量为 m)与 N60形成的化合物晶体结构如上图所示(其中白球代表 N60,黑球代表金属 M),若其晶胞边 长 为kpm,NA代 表 阿 伏 加 德 罗 常 数 的 值 , 则 其 密 度 为_____g·cm—3,该化合物中 N60的配位数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是( )
A. pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol·L-1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的乙二酸(H2C2O4)溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
D. pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1mol·L1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是
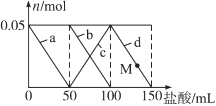
A. a曲线表示的离子方程式为:AlO2-+H++H2O===Al(OH)3↓
B. b和c曲线表示的离子反应是相同的
C. M点时,溶液中沉淀的质量为3.9g
D. 原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂解气主要含有丙烯、1,3-丁二烯等不饱和烃,以它们为原料可合成CR橡胶和医药中间体G,,合成路线如下:

已知:①B、C、D 均能发生银镜反应;
②
(1)A的顺式异构体的结构简式为___________________。
(2)C中含氧官能团的名称是____________,反应①的反应类型为____________________。
(3)写出E→ 反应的化学方程式:_________________________________。
(4)写出同时满足下列条件的医药中间体G的同分异构体的结构简式: __________________。
①与D 互为同系物; ②核磁共振氢谱有三组峰。
(5)用简要语言表述检验B中所含官能团的实验方法:_______________________。
(6)以A为起始原料合成CR橡胶的线路为______________________(其它试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com