
【题目】(1)常温下,将1mLpH=1的H2SO4溶液加水稀释到100mL,稀释后的溶液中 =_________。
=_________。
(2)某温度时,测得0.01mol·L-1的NaOH溶液的pH 为11,则该温度下水的离子积常数Kw=_________。该温度_________(填“高于“或“低于")25℃。
(3)常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为c2,则![]() =_________。
=_________。
(4)常温下,pH=13的Ba(OH)2溶液aL与pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计),若所得混合溶液呈中性,则a∶b=_________。
【答案】 108 1×10-13 高于 10-4 1∶100
【解析】(1)常温下,将1mLpH=1的H2SO4溶液加水稀释到100mL,稀释后的pH=3,则溶液中 =10-3÷10-11=108。(2)某温度时,测得0.01mol·L-1的NaOH溶液的pH为11,其中氢氧根浓度是0.01mol/L,所以该温度下水的离子积常数Kw=10-11×0.01=1×10-13。水的电离吸热,所以该温度高于25℃。(3)硫酸抑制水的电离,常温下pH=5的H2SO4溶液中由水电离出的H+浓度为10-9mol/L;硫酸铝水解,促进水的电离,则pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为10-5mol/L,则
=10-3÷10-11=108。(2)某温度时,测得0.01mol·L-1的NaOH溶液的pH为11,其中氢氧根浓度是0.01mol/L,所以该温度下水的离子积常数Kw=10-11×0.01=1×10-13。水的电离吸热,所以该温度高于25℃。(3)硫酸抑制水的电离,常温下pH=5的H2SO4溶液中由水电离出的H+浓度为10-9mol/L;硫酸铝水解,促进水的电离,则pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为10-5mol/L,则![]() =1×10-4。(4)所得混合溶液呈中性,说明氢离子与氢氧根的物质的量相等,即aL×0.1mol/L=bL×0.001mol/L,则a∶b=1∶100。
=1×10-4。(4)所得混合溶液呈中性,说明氢离子与氢氧根的物质的量相等,即aL×0.1mol/L=bL×0.001mol/L,则a∶b=1∶100。


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表前四周期的一部分,下列是有关R、W、X、Y、Z五种元素的叙述,其中正确的是
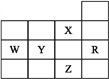
A. X元素是电负性最大的元素
B. p能级未成对电子最多的是Z元素
C. Y、Z的阴离子电子层结构都与R原子的相同
D. W元素的第一电离能小于Y元素的第一电离能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块金属钠投入到滴有紫色石蕊试液的盛冷水的烧杯中,甲同学认为可观察到下列现象,其中正确的有( )
①钠投入水中,先沉入水底,后浮出水面
②钠立即与水反应,并有气体产生
③反应后溶液变红
④钠熔成闪亮的小球
⑤小球在水面上四处游动
⑥有“嘶嘶”的响声发出
A. ①②③④ B. ②③④⑤
C. ②④⑤⑥ D. ③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,亚砷酸(H3AsO3)水溶液中含砷的各物种的分布分数(平衡时某物种的物质的量浓度占各物种的物质的量浓度之和的分数)与pH的关系如图所示。下列说祛正确的是

A. 以酚酞为指示剂,用NaOH溶液滴定到终点时发生的主要反应为H3AsO3+2OH-==HasO32-+H2O
B. pH=11时,溶液中有c(H2AsO3-)+2c(HAsO32-)+c(OH-)=c(H+)
C. 若将亚砷酸溶液加水稀释,则稀释过程中c(HAsO32-)/ c(H2AsO3-)减小
D. Ka1(H3AsO3)的数量级为10-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氨基水杨酸钠(PAS-Na)是抑制结核杆茵最有效的药物。某同学设计的合成PAS-Na的两种路线如下:
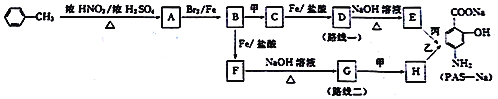
已知以下信息:
①甲、乙、丙为常用的无机试剂;
②![]()
③![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
回答下列问题:
(1)甲和丙的名称分别是_________________、____________________。
(2)E的结构简式是______________________。
(3)A→B的化学方程式是______________________________________,反应类型是______。
(4)A的同分异构体中氨基(一NH2)与苯环直接相连并且能发生银镜反应的有____种,其中核磁共振氢谱为4组峰且面积之比为2:2:2:1的结构简式为___________。
(5)有同学认为“路线二”不合理,不能制备PAS-Na,你的观点及理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中不正确的个数是
①铝在空气中很容易燃烧
②明矾在水中能生成Al(OH)3胶体,可用作净水剂
③含硅4%的钢具有良好的导磁性,可用来制造变压器铁芯
④滴有酚酞溶液的水中加Na2O2,溶液变红
⑤取等量的两瓶失去标签的Na2CO3和NaHCO3无色饱和溶液于两支试管中,滴加Ba(OH)2溶液, 生成白色沉淀的是Na2CO3溶液
⑥铁红是磁性氧化铁,常用作红色油漆和涂料
⑦铁与水蒸气在高温下的反应产物为Fe2O3和H2
A. 2个 B. 3个 C. 4个 D. 5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用。从钛白工业废酸(含钪、钛、铁、锰等离子)中提取氧化钪(Sc2O3)的一种流程如下:
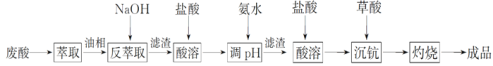
回答下列问题:
(1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是______________________________。
(2)先加入氨水调节pH=3,过滤,滤渣主要成分是__________;再向滤液加入氨水调节pH=6,滤液中Sc3+的浓度为_____________。(已知:Ksp[Mn(OH)2]=1.9×10-13、Ksp[Fe(OH)3]=2.6×10-39,Ksp[Sc(OH)3]=9.0×10-31)
(3)用草酸“沉钪”。25 ℃时pH=2的草酸溶液中![]() =__________(保留两位有效数字)。写出“沉钪”得到草酸钪的离子方程式__________________________________。[已知Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5]
=__________(保留两位有效数字)。写出“沉钪”得到草酸钪的离子方程式__________________________________。[已知Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5]
(4)草酸钪“灼烧”氧化的化学方程式为______________________________________________。
(5)废酸中含钪量为15 mg·L-1,V L废酸最多可提取Sc2O3的质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 硅晶体中,有NA个Si就有2 NA个Si—Si键
B. 常温常压下,等物质的量浓度的Na2CO3与Na2S溶液中Na+数目相等
C. 惰性电极电解食盐水,若线路中通过2 NA个电子的电量时,则阳极产生气体22.4 L
D. 标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com