
【题目】对氨基水杨酸钠(PAS-Na)是抑制结核杆茵最有效的药物。某同学设计的合成PAS-Na的两种路线如下:
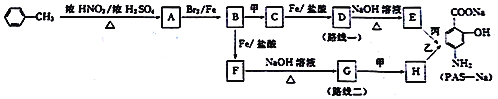
已知以下信息:
①甲、乙、丙为常用的无机试剂;
②![]()
③![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
回答下列问题:
(1)甲和丙的名称分别是_________________、____________________。
(2)E的结构简式是______________________。
(3)A→B的化学方程式是______________________________________,反应类型是______。
(4)A的同分异构体中氨基(一NH2)与苯环直接相连并且能发生银镜反应的有____种,其中核磁共振氢谱为4组峰且面积之比为2:2:2:1的结构简式为___________。
(5)有同学认为“路线二”不合理,不能制备PAS-Na,你的观点及理由是_____________。
【答案】 高锰酸钾酸性溶液 二氧化碳 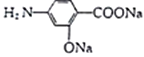
![]() 取代反应 13
取代反应 13 ![]() 路线二不能制备PAS-Na,当苯环上连接有一NH2时,-NH2会被KMnO4酸性溶液氧化
路线二不能制备PAS-Na,当苯环上连接有一NH2时,-NH2会被KMnO4酸性溶液氧化
【解析】由对氨基水杨酸钠的结构可知,![]() 与浓硝酸,在浓硫酸、加热条件下发生对位硝化反应生成A,则A为
与浓硝酸,在浓硫酸、加热条件下发生对位硝化反应生成A,则A为![]() ,A与溴在Fe作催化剂条件下发生取代反应生成B,由对氨基水杨酸钠的结构可知,应发生甲基的邻位取代,故B为
,A与溴在Fe作催化剂条件下发生取代反应生成B,由对氨基水杨酸钠的结构可知,应发生甲基的邻位取代,故B为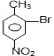 ;路线一的设计目的是,由于酚羟基、氨基易被氧化,故生成C的反应应为氧化反应,B被酸性高锰酸钾氧化生成C,则C为
;路线一的设计目的是,由于酚羟基、氨基易被氧化,故生成C的反应应为氧化反应,B被酸性高锰酸钾氧化生成C,则C为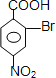 ,C在Fe、盐酸条件下发生还原反应生成D为
,C在Fe、盐酸条件下发生还原反应生成D为 ,D在碱性条件下水解生成E为
,D在碱性条件下水解生成E为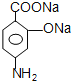 ,E转化对氨基水杨酸钠,只有E中酚羟基反应,而相同条件下,同浓度的对氨基水杨酸的酸性强于醋酸,故丙可以为二氧化碳;路线二的设计目的是,B在Fe、盐酸条件下发生还原反应生成F为
,E转化对氨基水杨酸钠,只有E中酚羟基反应,而相同条件下,同浓度的对氨基水杨酸的酸性强于醋酸,故丙可以为二氧化碳;路线二的设计目的是,B在Fe、盐酸条件下发生还原反应生成F为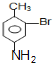 ,F发生水解反应生成G为
,F发生水解反应生成G为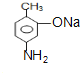 ,再用酸性高锰酸钾氧化,G中甲基、氨基都会被氧化,合成失败。
,再用酸性高锰酸钾氧化,G中甲基、氨基都会被氧化,合成失败。
(1)由上述分析可知,甲的名称是酸性高锰酸钾溶液,丙的化学式是CO2;
(2) 在碱性条件下水解生成E,则E的结构简式是
在碱性条件下水解生成E,则E的结构简式是 ;
;
(3)A→B的反应为![]() 与溴在Fe作催化剂条件下发生取代反应生成
与溴在Fe作催化剂条件下发生取代反应生成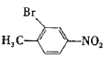 ,反应的化学方程式是:
,反应的化学方程式是: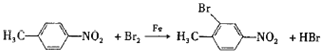 ;
;
(4)A的同分异构体中氨基(一NH2)与苯环直接相连并且能发生银镜反应,说明A的同分异构体中含有醛基或甲酸酯基结构,若含有醛基,则一定还含有羟基,应该有10种结构;若含有甲酸酯基结构,应该有3种结构,共有13种。核磁共振氢谱为4组峰且面积之比为2:2:2:1的结构简式为![]() 。
。
(5)路线二:B在Fe、盐酸条件下发生还原反应生成F为 ,F发生水解反应生成G为
,F发生水解反应生成G为 ,再用酸性高锰酸钾氧化,G中甲基、氨基都会被氧化,合成失败。
,再用酸性高锰酸钾氧化,G中甲基、氨基都会被氧化,合成失败。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如图所示的微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是
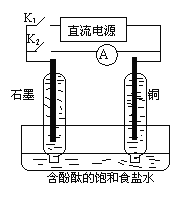
A. 断开K2,闭合K1时,总反应的离子方程式为:2H+ + 2Cl-![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 断开K2,闭合K1时,石墨电极附近溶液变红
C. 断开K1,闭合K2时,铜电极上的电极反应为: Cl2+2e-=2Cl-
D. 断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是
A. CO32- + H2O ![]() HCO3-+ OH- 热的纯碱溶液清洗油污
HCO3-+ OH- 热的纯碱溶液清洗油污
B. Al3+ + 3H2O ![]() Al(OH)3(胶体)+ 3H+ 明矾净水
Al(OH)3(胶体)+ 3H+ 明矾净水
C. SnCl2 + H2O ![]() Sn(OH)Cl↓ + HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓ + HCl 配制氯化亚锡溶液时加入氢氧化钠
D. TiCl4+ (x+2)H2O(过量) ![]() TiO2·x H2O↓ + 4HCl 用TiCl4制备TiO2
TiO2·x H2O↓ + 4HCl 用TiCl4制备TiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
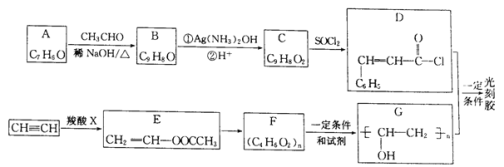
【题目】光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂和产物略去):
已知; 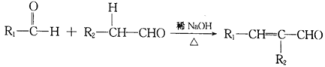 (R1、R2为烃基或氢)
(R1、R2为烃基或氢)
(1)A的名称为________;羧酸X的结构简式为___________________。
(2)C可与乙醇发生酯化反应,其化学方程式为____________,反应中乙醇分子所断裂的化学键是____________(填选项字母)。
aC——C键 b.C——H键 c.O——H键 d.C——O键
(3)E→F的化学方程式为___________;F到G的反应类型为_______________。
(4)写出满足下列条件B的2种同分异构体:___________、____________________。
①分子中含有苯环;②能发生银镜反应;③核磁共振氢谱峰面积比为2:2:2:1:1。
(5)根据已有知识并结合相关信息,写出以CH3CHO为原料制备CH3COCOCOOH的合成路线流程图(无机试剂任用):___________________________。合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效提升空气质量,国家强制各燃煤企业要对燃煤烟气进行脱硫、脱硝处理后排放。回答下列问题:
(1)燃煤烟气“脱硝”中涉及到的部分反应如下:
a.4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(g) △H 1
5N2(g)+6H2O(g) △H 1
b.4NH3(g)+5O2(g) ![]() 4NO(g)+6 H2O(g)△H2 =-925kJ·mol-1
4NO(g)+6 H2O(g)△H2 =-925kJ·mol-1
c.N2(g)+O2(g) ![]() 2NO(g)△H 3=+175kJ·mol-1
2NO(g)△H 3=+175kJ·mol-1
则△H 1=_____kJ/mol。
(2)向某恒容密闭容器中加入2molNH3、3molNO,在适当条件下发生(1)中反应a,反应过程中NO的平衡转化率随温度T、压强p的变化曲线如图所示:
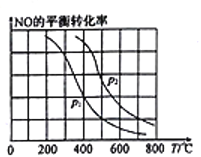
①p1________p2(填“>”“<”或“=”)。
②若在压强为加p2、温度为600℃时,达到平衡时反应体系内化学能降低了300kJ,则NO的转化率为_______________________。
③600℃时,下列各项数据中能表明该反应已达到化学平衡状态的是______。
a.水与NO的生成速率相等 b.混合气体的密度保持不变
c. NH3、NO生成速率比为5:4 d.容器的总压强保持不变
(3)将2molN2、3molH2O、0.5molNO的混合气体置于x、y、z三个容积相同的恒容密闭容器中,控制适当的条件发生反应,反应过程中c(NO)随时间的变化如图所示。
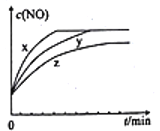
①在建立平衡的过程中,三个容器中反应速率的相对大小为______________。
②与y容器中反应相比,z容器中反应改变的条件及判断依据分别是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,将1mLpH=1的H2SO4溶液加水稀释到100mL,稀释后的溶液中 =_________。
=_________。
(2)某温度时,测得0.01mol·L-1的NaOH溶液的pH 为11,则该温度下水的离子积常数Kw=_________。该温度_________(填“高于“或“低于")25℃。
(3)常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为c2,则![]() =_________。
=_________。
(4)常温下,pH=13的Ba(OH)2溶液aL与pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计),若所得混合溶液呈中性,则a∶b=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四只盛有不同溶液的烧杯中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):
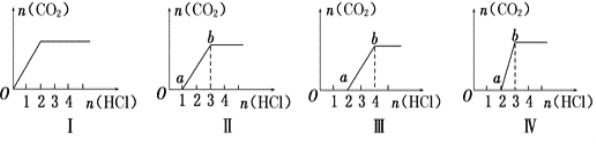
则下列分析都正确的组合是( )
①I图对应溶液中的溶质为NaHCO3
②II图对应溶液中的溶质为Na2CO3和NaHCO3,且二者的物质的量之比为1:1
③III图对应溶液中的溶质为NaOH和Na2CO3,且二者的物质的量之比为1:1
④IV图对应溶液中的溶质为Na2CO3
A.①② B.①③ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(主要成分CuFeS2)是提取Cu的主要原料。
已知:2CuFeS2+4O2![]() Cu2S+3SO2+2FeO(Ⅰ)
Cu2S+3SO2+2FeO(Ⅰ)
产物Cu2S在1200 ℃高温下继续反应:2Cu2S+3O2==2Cu2O+2SO2 (Ⅱ)
2Cu2O+Cu2S==6Cu +SO2↑ (Ⅲ)
假定各步反应都完全。则下列说法正确的是
A. 反应Ⅰ中CuFeS2仅作还原剂
B. 取12.5g黄铜矿样品,经测定含3.60g硫,则矿样中CuFeS2质量分数一定为82.8%
C. 由6molCuFeS2生成6molCu消耗O2的物质的量为14.25mol
D. 6molCuFeS2和15.75molO2反应,理论上可得到铜的物质的量为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)为了证明NH3·H2O是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验。0.010mol·L-1氨水、0.1mol·L-1NH4Cl溶液、NH4Cl晶体、酚酞溶液、pH试纸、蒸馏水。
①甲用pH试纸测出0.010mol·L-1氨水的pH为10,则认定NH3·H2O是弱电解质,你认为这一方法________(填“正确”或“不正确”),并说明理由:__________________________________。
②乙取出10mL0.010mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1000mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b值应满足的关系是_____。
(II)(1)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=________。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com