
【题目】钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用。从钛白工业废酸(含钪、钛、铁、锰等离子)中提取氧化钪(Sc2O3)的一种流程如下:
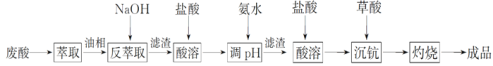
回答下列问题:
(1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是______________________________。
(2)先加入氨水调节pH=3,过滤,滤渣主要成分是__________;再向滤液加入氨水调节pH=6,滤液中Sc3+的浓度为_____________。(已知:Ksp[Mn(OH)2]=1.9×10-13、Ksp[Fe(OH)3]=2.6×10-39,Ksp[Sc(OH)3]=9.0×10-31)
(3)用草酸“沉钪”。25 ℃时pH=2的草酸溶液中![]() =__________(保留两位有效数字)。写出“沉钪”得到草酸钪的离子方程式__________________________________。[已知Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5]
=__________(保留两位有效数字)。写出“沉钪”得到草酸钪的离子方程式__________________________________。[已知Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5]
(4)草酸钪“灼烧”氧化的化学方程式为______________________________________________。
(5)废酸中含钪量为15 mg·L-1,V L废酸最多可提取Sc2O3的质量为____________。
【答案】 将浓硫酸沿烧杯内壁慢慢注入水中,并用玻璃棒不断搅拌,冷却后再慢慢注入 H2O2中,并不断搅拌 Fe(OH)3 9.0×10-7mol·L-l 3.8×10-2 2Sc3++ 3H2C2O4===Sc2(C2O4)3↓+ 6H+ 2Sc2(C2O4)3+3O2![]() 2Sc2O3+12CO2 0.023V g
2Sc2O3+12CO2 0.023V g
【解析】
(1)不同的液体在混合时,一般先加密度较小,易挥发的,后加密度大的、难挥发的,若混合时放热,则最后加受热易分解的,因此,混合的实验操作是将浓硫酸沿烧杯内壁慢慢注入水中,并用玻璃棒不断搅拌,冷却后再慢慢注入 H2O2中,并不断搅拌;(2)废酸中含钪、钛、铁、锰等离子,洗涤“油相”已除去大量的钛离子,根据Ksp[Mn(OH)2]=1.9×10-13、Ksp[Fe(OH)3]=2.6×10-39,Ksp[Sc(OH)3]=9.0×10-31,可以求出余下三种离子沉淀完全(离子浓度小于10-5mol/L)的pH,发现锰离子沉淀完全时pH约为10,钪离子沉淀完全时pH约为5,而铁离子沉淀完全时pH约为4,所以先加入氨水调节pH=3,过滤,滤渣主要成分是Fe(OH)3;再向滤液加入氨水调节pH=6,此时溶液中c(OH-)=10-8mol/L,滤液中Sc3+的浓度为![]() ;(3) 25 ℃时pH=2的草酸溶液中
;(3) 25 ℃时pH=2的草酸溶液中![]() =
=![]() =
=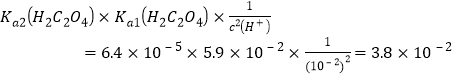 , “沉钪”得到草酸钪的离子方程式为2Sc3++ 3H2C2O4===Sc2(C2O4)3↓+ 6H+;(4)草酸钪“灼烧”氧化的化学方程式为2Sc2(C2O4)3+3O2
, “沉钪”得到草酸钪的离子方程式为2Sc3++ 3H2C2O4===Sc2(C2O4)3↓+ 6H+;(4)草酸钪“灼烧”氧化的化学方程式为2Sc2(C2O4)3+3O2![]() 2Sc2O3+12CO2;(5)废酸中含钪量为15 mg·L-1,则V L废酸中含钪的质量为15
2Sc2O3+12CO2;(5)废酸中含钪量为15 mg·L-1,则V L废酸中含钪的质量为15![]() ,所以最多可提取Sc2O3的质量为
,所以最多可提取Sc2O3的质量为![]() 。
。


科目:高中化学 来源: 题型:
【题目】某有机物结构简式如下图所示,下列说法正确的是
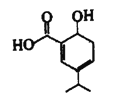
A. 分子式为C10H12O3 B. 能使酸性KMnO4溶液或溴水褪色
C. lmol该有机物可中和2molNaOH D. 1mol该有机物最多可与3molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂和产物略去):
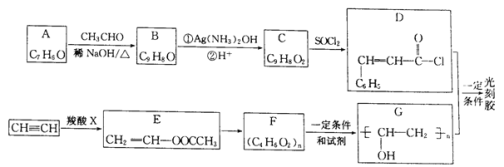
已知; 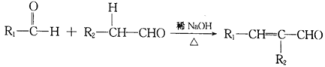 (R1、R2为烃基或氢)
(R1、R2为烃基或氢)
(1)A的名称为________;羧酸X的结构简式为___________________。
(2)C可与乙醇发生酯化反应,其化学方程式为____________,反应中乙醇分子所断裂的化学键是____________(填选项字母)。
aC——C键 b.C——H键 c.O——H键 d.C——O键
(3)E→F的化学方程式为___________;F到G的反应类型为_______________。
(4)写出满足下列条件B的2种同分异构体:___________、____________________。
①分子中含有苯环;②能发生银镜反应;③核磁共振氢谱峰面积比为2:2:2:1:1。
(5)根据已有知识并结合相关信息,写出以CH3CHO为原料制备CH3COCOCOOH的合成路线流程图(无机试剂任用):___________________________。合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,将1mLpH=1的H2SO4溶液加水稀释到100mL,稀释后的溶液中 =_________。
=_________。
(2)某温度时,测得0.01mol·L-1的NaOH溶液的pH 为11,则该温度下水的离子积常数Kw=_________。该温度_________(填“高于“或“低于")25℃。
(3)常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为c2,则![]() =_________。
=_________。
(4)常温下,pH=13的Ba(OH)2溶液aL与pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计),若所得混合溶液呈中性,则a∶b=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四只盛有不同溶液的烧杯中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):
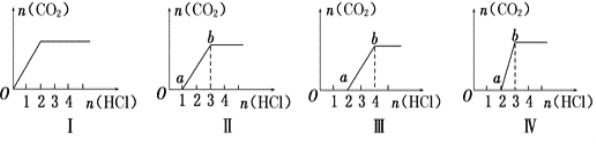
则下列分析都正确的组合是( )
①I图对应溶液中的溶质为NaHCO3
②II图对应溶液中的溶质为Na2CO3和NaHCO3,且二者的物质的量之比为1:1
③III图对应溶液中的溶质为NaOH和Na2CO3,且二者的物质的量之比为1:1
④IV图对应溶液中的溶质为Na2CO3
A.①② B.①③ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化合物CH2=C(CH3)COOCH2CH2OH 的说法不正确是( )
A. 能发生加成、取代和消去反应 B. 存在顺反异构体
C. 能使酸性高锰酸钾溶液褪色 D. 能和NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(主要成分CuFeS2)是提取Cu的主要原料。
已知:2CuFeS2+4O2![]() Cu2S+3SO2+2FeO(Ⅰ)
Cu2S+3SO2+2FeO(Ⅰ)
产物Cu2S在1200 ℃高温下继续反应:2Cu2S+3O2==2Cu2O+2SO2 (Ⅱ)
2Cu2O+Cu2S==6Cu +SO2↑ (Ⅲ)
假定各步反应都完全。则下列说法正确的是
A. 反应Ⅰ中CuFeS2仅作还原剂
B. 取12.5g黄铜矿样品,经测定含3.60g硫,则矿样中CuFeS2质量分数一定为82.8%
C. 由6molCuFeS2生成6molCu消耗O2的物质的量为14.25mol
D. 6molCuFeS2和15.75molO2反应,理论上可得到铜的物质的量为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2可将正常的血红蛋白中的二价铁变为高铁血红蛋白中的三价铁,失去携氧能力。完成下列填空:
(1)N元素在元素周期表中位于第____族,N原子的结构示意图______________。
(2)Na、N、O三种元素形成的简单离子中,离子半径最小的是_______(用离子符号表示)。
(3)某工厂的废液中含有2%~5%的NaNO2直接排放会造成污染。下列试剂中,能使NaNO2转化为N2的是______________(选填编号)。
a.NaCl b.NH4Cl c.HNO3 d.H2SO4
(4)已知NaNO2能发生如下反应:NaNO2 + HI → NO↑+ I2 + NaI + H2O
①配平反应物的系数并标出电子转移的方向和数目__NaNO2 +__ HI → NO↑+ I2 + NaI + H2O 。
②当有0.75mol HI被氧化时,在标准状况下产生气体的体积是_______L。
(5)NaNO2外观与食盐相似,根据上述反应,可用于鉴别NaNO2和NaCl。现有 ①白酒、②碘化钾淀粉试纸、③淀粉、④白糖、⑤白醋,其中可选用的物质至少有______(选填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是( )
A. pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol·L-1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的乙二酸(H2C2O4)溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
D. pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com