
【题目】下列关于化合物CH2=C(CH3)COOCH2CH2OH 的说法不正确是( )
A. 能发生加成、取代和消去反应 B. 存在顺反异构体
C. 能使酸性高锰酸钾溶液褪色 D. 能和NaOH溶液反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】硅、铜、镓、硒等化学物质可作为制造太阳能电池板的材料。
(1)镓是ⅢA族元素,写出基态镓原子的核外电子排布式__________________。
(2)硒为第四周期ⅥA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由大到小的顺序为______________(用元素符号表示)。
(3)SeO3分子的立体构型为____,与硒同主族元素的氢化物(化学式为H2R)中,沸点最低的物质化学式为____。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的关系如图所示,呈现这种变化的原因是____________。

(5)金属铜投入氨水中或投入过氧化氢溶液中均无明显现象,但投入氨水与过氧化氢的混合液中,则铜片溶解,溶液呈深蓝色,写出使溶液呈深蓝色的离子的化学式_____。
(6)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数之比为____________,若该晶体的晶胞边长为a pm,则该合金的密度为________________g·cm-3(列出计算式,不要求计算结果,设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,亚砷酸(H3AsO3)水溶液中含砷的各物种的分布分数(平衡时某物种的物质的量浓度占各物种的物质的量浓度之和的分数)与pH的关系如图所示。下列说祛正确的是

A. 以酚酞为指示剂,用NaOH溶液滴定到终点时发生的主要反应为H3AsO3+2OH-==HasO32-+H2O
B. pH=11时,溶液中有c(H2AsO3-)+2c(HAsO32-)+c(OH-)=c(H+)
C. 若将亚砷酸溶液加水稀释,则稀释过程中c(HAsO32-)/ c(H2AsO3-)减小
D. Ka1(H3AsO3)的数量级为10-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中不正确的个数是
①铝在空气中很容易燃烧
②明矾在水中能生成Al(OH)3胶体,可用作净水剂
③含硅4%的钢具有良好的导磁性,可用来制造变压器铁芯
④滴有酚酞溶液的水中加Na2O2,溶液变红
⑤取等量的两瓶失去标签的Na2CO3和NaHCO3无色饱和溶液于两支试管中,滴加Ba(OH)2溶液, 生成白色沉淀的是Na2CO3溶液
⑥铁红是磁性氧化铁,常用作红色油漆和涂料
⑦铁与水蒸气在高温下的反应产物为Fe2O3和H2
A. 2个 B. 3个 C. 4个 D. 5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用。从钛白工业废酸(含钪、钛、铁、锰等离子)中提取氧化钪(Sc2O3)的一种流程如下:
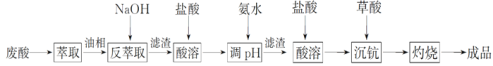
回答下列问题:
(1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是______________________________。
(2)先加入氨水调节pH=3,过滤,滤渣主要成分是__________;再向滤液加入氨水调节pH=6,滤液中Sc3+的浓度为_____________。(已知:Ksp[Mn(OH)2]=1.9×10-13、Ksp[Fe(OH)3]=2.6×10-39,Ksp[Sc(OH)3]=9.0×10-31)
(3)用草酸“沉钪”。25 ℃时pH=2的草酸溶液中![]() =__________(保留两位有效数字)。写出“沉钪”得到草酸钪的离子方程式__________________________________。[已知Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5]
=__________(保留两位有效数字)。写出“沉钪”得到草酸钪的离子方程式__________________________________。[已知Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5]
(4)草酸钪“灼烧”氧化的化学方程式为______________________________________________。
(5)废酸中含钪量为15 mg·L-1,V L废酸最多可提取Sc2O3的质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的总反应:3Fe2++2S2O32—+O2+x M===Fe3O4+S4O62—+2H2O,有关说法正确的是 ( )
A. 每转移3mol电子,有1.5mol Fe2+被氧化
B. M为OH—离子,x=2
C. O2、S2O32—都是氧化剂
D. 每生成1molFe3O4,反应中转移2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 硅晶体中,有NA个Si就有2 NA个Si—Si键
B. 常温常压下,等物质的量浓度的Na2CO3与Na2S溶液中Na+数目相等
C. 惰性电极电解食盐水,若线路中通过2 NA个电子的电量时,则阳极产生气体22.4 L
D. 标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)高铁酸钾![]() 是一种新型、高效、多功能水处理剂。某学习小组设计如下方案制备高铁酸钾:
是一种新型、高效、多功能水处理剂。某学习小组设计如下方案制备高铁酸钾:
![]()
①高铁酸钾中铁元素的化合价为________,据此推测它具有的化学性质是____________。
②其中第一步操作是:在NaClO溶液中加入烧碱固体形成强碱性环境,将研磨过的硝酸铁少量多次地加入上述溶液中,冰水浴中反应1 h。发生的离子反应为2Fe3++3ClO-+10OH-===2FeO![]() +3Cl-+5H2O,还原剂是_____________。
+3Cl-+5H2O,还原剂是_____________。
③高铁酸钾和水发生反应,生成物能吸附杂质净水,同时还产生气体,写出反应的离子方程式:___________________。
(2)某Fe 2(SO4) 3样品含有少量FeSO4杂质,为了测定该样品中铁元素的含量,设计如下实验:
Ⅰ.称取样品m g,加入稀H2SO4,后加水配制成250.00 mL溶液;
Ⅱ.取25.00 mL溶液,先加入![]() ,然后再加过量的氨水,过滤;
,然后再加过量的氨水,过滤;
Ⅲ.将沉淀用蒸馏水洗涤数次后,烘干;
Ⅳ.灼烧至质量不再减少为止,得到红棕色固体,冷却后称量,质量为n g。
请根据上面操作流程,回答以下问题:
①步骤Ⅰ中称量使用的仪器是________________,配制用到的仪器有烧杯、玻璃棒、胶头滴管,还要补充的玻璃仪器是____________________。
②步骤Ⅱ中过滤用的仪器有滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是_________;加入![]() 的主要目的是________________。
的主要目的是________________。
③步骤Ⅲ中检验该沉淀已经洗涤干净的操作是________________。
④若要检验溶液中的![]() ,则应该加入________________试剂。
,则应该加入________________试剂。
⑤计算该样品中铁元素的质量分数的表达式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g),K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g),K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com