
【题目】硅、铜、镓、硒等化学物质可作为制造太阳能电池板的材料。
(1)镓是ⅢA族元素,写出基态镓原子的核外电子排布式__________________。
(2)硒为第四周期ⅥA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由大到小的顺序为______________(用元素符号表示)。
(3)SeO3分子的立体构型为____,与硒同主族元素的氢化物(化学式为H2R)中,沸点最低的物质化学式为____。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的关系如图所示,呈现这种变化的原因是____________。

(5)金属铜投入氨水中或投入过氧化氢溶液中均无明显现象,但投入氨水与过氧化氢的混合液中,则铜片溶解,溶液呈深蓝色,写出使溶液呈深蓝色的离子的化学式_____。
(6)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数之比为____________,若该晶体的晶胞边长为a pm,则该合金的密度为________________g·cm-3(列出计算式,不要求计算结果,设阿伏加德罗常数的值为NA)。
【答案】 1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1) Br>Se>As 平面三角形 H2S 硅烷为分子晶体,随硅烷相对分子质量的增大,分子间作用力增强,沸点升高 [Cu(NH3)4]2+ 1∶3 ![]()
【解析】(1) 镓处于第四周期ⅢA族,镓基态原子的电子排布式:1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1;(2)砷、硒、溴三种元素都是第4周期非金属元素,同一周期元素自左而右电负性增大,故电负性:Br>Se>As;(3)气态SeO3分子中心原子Se的价层电子对数为3+![]() =3,无孤电子对,所以分子构型为平面三角形;H2O存在氢键,沸点最高,同主族其他氢化物随着相对分子质量的增大熔沸点增大,故与硒同主族元素的氢化物(化学式为H2R)中,沸点最低的物质化学式为H2S;(4)硅烷(SinH2n+2)都是分子晶体,分子晶体的沸点高低取决于分子间作用力,硅烷的相对分子质量越大,分子间作用力越强,熔沸点升高;(5)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,说明两者能互相促进,是两种物质共同作用的结果,其中过氧化氢为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行,离子方程式为:Cu+H2O2+4NH3H2O=Cu(NH3)42++2OH-+4H2O,使溶液呈深蓝色的离子的化学式为[Cu(NH3)4]2+;(7)在晶胞中,Au原子位于顶点,Cu原子位于面心,该晶胞中Au原子个数=8×
=3,无孤电子对,所以分子构型为平面三角形;H2O存在氢键,沸点最高,同主族其他氢化物随着相对分子质量的增大熔沸点增大,故与硒同主族元素的氢化物(化学式为H2R)中,沸点最低的物质化学式为H2S;(4)硅烷(SinH2n+2)都是分子晶体,分子晶体的沸点高低取决于分子间作用力,硅烷的相对分子质量越大,分子间作用力越强,熔沸点升高;(5)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,说明两者能互相促进,是两种物质共同作用的结果,其中过氧化氢为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行,离子方程式为:Cu+H2O2+4NH3H2O=Cu(NH3)42++2OH-+4H2O,使溶液呈深蓝色的离子的化学式为[Cu(NH3)4]2+;(7)在晶胞中,Au原子位于顶点,Cu原子位于面心,该晶胞中Au原子个数=8×![]() =1,Cu原子个数=6×
=1,Cu原子个数=6×![]() =3,所以该合金中Au原子与Cu原子个数之比=1:3,
=3,所以该合金中Au原子与Cu原子个数之比=1:3,
晶胞体积V=(a×10-10cm)3,每个晶胞中铜原子个数是3、Au原子个数是1,晶胞质量为![]() g,则晶胞密度ρ=
g,则晶胞密度ρ=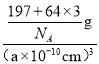 =
=![]() g.cm-3
g.cm-3


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:

已知:RX![]() ROH;RCHO+CH3COOR’
ROH;RCHO+CH3COOR’![]() RCH=CHCOOR’ 请回答:
RCH=CHCOOR’ 请回答:
(1) A中官能团的名称是______________________。
(2) D→E的化学方程式________________________________________________。
(3) X的结构简式_________________。
(4)与F互为同分异构体又满足下列条件的有_______种。
①遇到氯化铁溶液会显紫色,②会发生银镜反应 ③苯环上有三个取代基
在其它同分异构体中核磁共振氢谱有六组峰,氢原子数比符合1:2:2:2:2:1的结构为_____。
(5)根据上面合成信息及试剂,写出以乙烯为原料(无机试剂任选),写出合成CH3CH=CHCOOCH2CH3路线。_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是()

A. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
B. 每生成2 mol AB(g)吸收b kJ能量
C. 该反应中反应物的总能量高于生成物的总能量
D. 该反应热ΔH=(a-b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界能源消费的90%以上依靠化学技术。
(1)工业制氢的一个重要反应是利用CO还原H2O(g)。已知:
C(石墨,s)+O2(g)===CO2(g) ΔH=-394 kJ·mol-1
2C(石墨,s)+O2(g)===2CO(g) ΔH=-222 kJ·mol-1
H2(g)+![]() O2(g)===H2O(g) ΔH=-242 kJ·mol-1
O2(g)===H2O(g) ΔH=-242 kJ·mol-1
则CO还原H2O(g)的热化学方程式为__________________。
(2)氢能被视为最具发展潜力的绿色能源,写出碱式氢氧燃料电池工作时的负极电极反应式:______________________________________________________________。
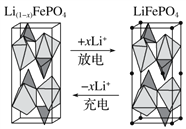
(3)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如下图,写出该电池充电时的阳极电极反应式:___________。
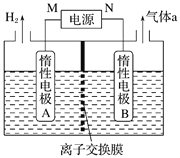
(4)LiOH是制备锂离子电池正极材料的重要原料,其电解法制备装置如下图。气体a通入淀粉KI溶液中,发现溶液变蓝,持续一段时间后,蓝色逐渐褪去。则M极为电源的_______(填“正”或“负”)极,B极区电解液为_______(填化学式)溶液,该离子交换膜是_______(填“阳”或“阴”)离子交换膜,解释蓝色褪去的原因_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式如下图所示,下列说法正确的是
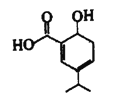
A. 分子式为C10H12O3 B. 能使酸性KMnO4溶液或溴水褪色
C. lmol该有机物可中和2molNaOH D. 1mol该有机物最多可与3molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.1mol/L、体积为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg(V/ V0)的变化关系如图所示。下列叙述正确的是( )

A. HX、HY都是弱酸,且HX的酸性比HY的弱
B. 相同温度下,电离常数K(HX):a>b
C. 常温下,由水电离出的c(H+)·c(OH-):a<b
D. lg(V/ V0)=3,若同时微热两种溶液,则[c(X-)/c(Y-)]减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是
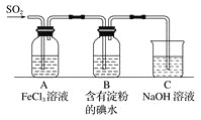
A. 能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B. 装置C的作用是吸收SO2尾气,防止污染空气
C. 为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
D. 为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化合物CH2=C(CH3)COOCH2CH2OH 的说法不正确是( )
A. 能发生加成、取代和消去反应 B. 存在顺反异构体
C. 能使酸性高锰酸钾溶液褪色 D. 能和NaOH溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com