
【题目】⑴氯碱工业是以惰性电极电解饱和食盐水,制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
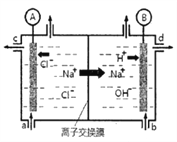
完成下列填空:
①离子交换膜的作用为:____________________。
②写出电解饱和食盐水的离子方程式_________。
③氢氧化钠溶液从图中_____位置流出。(选填a、b、c或d)
⑵电化学在日常生活中用途广泛,图①是镁次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O===Cl-+Mg(OH)2↓,图②是Cr2O![]() 的工业废水的处理,下列说法正确的是(____)
的工业废水的处理,下列说法正确的是(____)
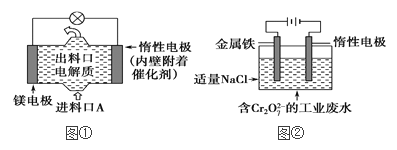
A.图②中Cr2O![]() 离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B.图②的电解池中,有0.084 g阳极材料参与反应,阴极会有33.6 mL的气体产生
C.图①中发生的还原反应是:Mg2++ClO-+H2O+2e-===Cl-+Mg(OH)2
D.若图①中3.6 g镁溶解产生的电量用以图②废水处理,理论可产生10.7 g氢氧化铁沉淀
⑶观察下列装置,回答下列问题:
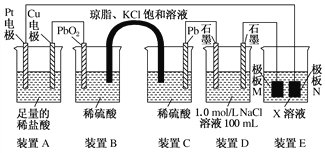
①装置B中PbO2上发生的电极反应方程式为_____________________________________。
②装置A中总反应的离子方程式为_____________________________________________。
③当装置A中Cu电极质量改变6.4 g时,装置D中产生的气体体积为________ L(标准状况下,不考虑气体的溶解)。
【答案】 阻止OH-进入阳极室,与Cl2发生副反应;阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸 2Cl-+2H2O![]() Cl2↑+H2↑+2OH- d C PbO2+4H++SO
Cl2↑+H2↑+2OH- d C PbO2+4H++SO![]() +2e-===PbSO4+2H2O Cu+2H+
+2e-===PbSO4+2H2O Cu+2H+![]() Cu2++H2↑ 3.92
Cu2++H2↑ 3.92
【解析】⑴①离子交换膜的作用为: 阻止OH-进入阳极室,与Cl2发生副反应;阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸;②电解饱和食盐水生成氢氧化钠、氢气和氯气,反应的离子方程式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;③电解槽中阴极是氢离子放电生成氢气,水电离平衡正向进行氢氧根离子浓度增大,生成氢氧化钠溶液,NaOH溶液的出口为d;⑵A、图②为电解池,Cr2O72-向阳极(Fe)移动,选项A错误;B、图②中阳极上发生的反应为:Fe-2e-=Fe2+,阴极上发生的反应为:2H2O+2e-=H2↑+2OH-,阳极上0.084 g铁参与反应,阴极上产生气体的体积(标准状况)为
Cl2↑+H2↑+2OH-;③电解槽中阴极是氢离子放电生成氢气,水电离平衡正向进行氢氧根离子浓度增大,生成氢氧化钠溶液,NaOH溶液的出口为d;⑵A、图②为电解池,Cr2O72-向阳极(Fe)移动,选项A错误;B、图②中阳极上发生的反应为:Fe-2e-=Fe2+,阴极上发生的反应为:2H2O+2e-=H2↑+2OH-,阳极上0.084 g铁参与反应,阴极上产生气体的体积(标准状况)为![]() ×22.4 L·mol-1=0.0336L,选项B错误;C、图①为原电池,正极上ClO-发生还原反应,且Mg2+向正极移动参与反应,电极反应式为Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓,选项C正确;D、若图①中3.6 g镁溶解,根据得失电子守恒,则图②中阳极上放电的铁的质量为m(Fe)=56 g·mol-1×n(Fe)=56 g·mol-1×n(Mg)=56 g·mol-1×
×22.4 L·mol-1=0.0336L,选项B错误;C、图①为原电池,正极上ClO-发生还原反应,且Mg2+向正极移动参与反应,电极反应式为Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓,选项C正确;D、若图①中3.6 g镁溶解,根据得失电子守恒,则图②中阳极上放电的铁的质量为m(Fe)=56 g·mol-1×n(Fe)=56 g·mol-1×n(Mg)=56 g·mol-1×![]() =8.4 g,根据Fe元素守恒知,产生Fe(OH)3的质量为
=8.4 g,根据Fe元素守恒知,产生Fe(OH)3的质量为![]() ×107=16.05(g),选项D错误。答案选C;(3)①B和C装置形成原电池,铅作负极,二氧化铅作正极,原电池放电时,正极上二氧化铅得电子和硫酸根离子反应生成硫酸铅,发生还原反应,电极反应式为:PbO2+4H++SO
×107=16.05(g),选项D错误。答案选C;(3)①B和C装置形成原电池,铅作负极,二氧化铅作正极,原电池放电时,正极上二氧化铅得电子和硫酸根离子反应生成硫酸铅,发生还原反应,电极反应式为:PbO2+4H++SO![]() +2e-=PbSO4+2H2O;②A连接电源,则A是电解池,左边Pt作阴极,右边Cu作阳极,阳极上Cu放电,阴极上氢离子放电,装置A中总反应的离子方程式为Cu+2H+
+2e-=PbSO4+2H2O;②A连接电源,则A是电解池,左边Pt作阴极,右边Cu作阳极,阳极上Cu放电,阴极上氢离子放电,装置A中总反应的离子方程式为Cu+2H+![]() Cu2++H2↑;③当装置A中Cu电极质量改变6.4g时,n(Cu)=0.1mol,则转移0.2mol电子,装置D中n(NaCl)=0.1mol,阳极首先发生2Cl--2e-=Cl2↑、其次发生4OH--4e-=2H2O+O2↑,则阳极首先生成0.05molCl2,其次生成0.025molO2,阴极只发生2H++2e-=H2↑,生成0.1molH2,则总共生成0.175mol气体,体积为0.175mol×22.4L/mol=3.92L。
Cu2++H2↑;③当装置A中Cu电极质量改变6.4g时,n(Cu)=0.1mol,则转移0.2mol电子,装置D中n(NaCl)=0.1mol,阳极首先发生2Cl--2e-=Cl2↑、其次发生4OH--4e-=2H2O+O2↑,则阳极首先生成0.05molCl2,其次生成0.025molO2,阴极只发生2H++2e-=H2↑,生成0.1molH2,则总共生成0.175mol气体,体积为0.175mol×22.4L/mol=3.92L。


科目:高中化学 来源: 题型:
【题目】常温下,向10mL1 molL-1HCl溶液中滴加1 molL-1CH3COONa溶液,所得混合液的pH 与加入CH3COONa溶液的体积(V)的变化如图所示。下列说祛错误的是
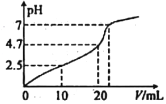
A. 常温下,CH3COOH 的电离常数Ka≈2.0×10-5
B. 随着V的增加,混合液中水的电离程度在不断增加
C. 当V=20 mL时,混合液中c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-)
D. 当混合液的pH=7时,混合液中c(Cl-)=c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室以含铁的铜屑为原料制备Cu(NO3)2·H2O晶体,并进一步探究用SOCl2制备少量无水Cu(NO3)2。设计的合成路线如下:

已知:Cu(NO3)2·3H2O ![]() Cu(NO3)2·Cu(OH)2
Cu(NO3)2·Cu(OH)2 ![]() CuO
CuO
SOCl2熔点―105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。
请回答:
(1)第②步调pH适合的物质是_________(填化学式)。
(2)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是_____________。为得到较大颗粒的Cu(NO3)2·3H2O晶体,可采用的方法是___________(填一种)。
(3)第④步中发生反应的化学方程式是_______________________。
(4)第④步,某同学设计的实验装置示意图(夹持及控温装置省略,如图)有一处不合理,请提出改进方案并说明理由___________________。

装置改进后,向仪器A中缓慢滴加SOCl2时,需打开活塞______(填“a”、“b”或“a和b”)。
(5)为测定无水Cu(NO3)2产品的纯度,可用分光光度法。
已知:4NH3·H2O + Cu2+ == Cu(NH3)42+ + 4H2O;Cu(NH3)42+ 对特定波长光的吸收程度(用吸光度A表示)与Cu2+ 在一定浓度范围内成正比。现测得Cu(NH3)42+的吸光度A与Cu2+ 标准溶液浓度关系如图所示:

准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100 mL,准确移取该溶液10.00mL,加过量NH3·H2O,再用蒸馏水定容至100 mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是_________(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂。肼(N2H4)与N2O4的反应为2N2H4(1)+N2O4(g)=3N2(g)+4H2O(g) △H = -1077 kJ/mol
已知相关反应的化学键键能数据如下:
![]()
则使1 mol N2O4(g)分子中化学键完全断裂时需要吸收的能量是__________ 。
(2)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度的变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度的变化如图所示。
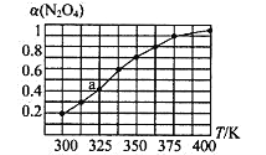
①由图推测该反应△H_______0(填“>”或“<”),理由为______________ 。
②图中a点对应温度下,己知N2O4的起始压强p0为108 kPa,则该温度下反应的平衡常数为:Kp=_____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,取四位有效数字)。
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率-压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=________,在下图标出的点中,能表示反应达到平衡状态的点为______。

(3)电解NO2制备NH4NO3,其工作原理如图所示。
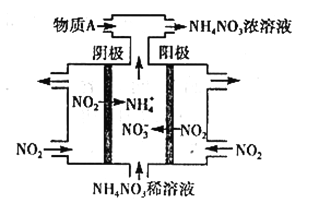
①阳极的电极反应式为_______________________。
②为使电解产物全部转化为NH4NO3,需补充物质A,则A的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若在加入铝粉能放出H2的溶液中,分别加入下列各组离子,肯定不能共存的
A. Fe3+、Mg2+、Cl-、Na+
B. Ba2+、Mg2+、![]() 、Ca2+
、Ca2+
C. ![]() 、Na+、K+、
、Na+、K+、![]()
D. ![]() 、K+、Al3+、H+
、K+、Al3+、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 mol Na2O2与2mol NaHCO3固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
A. NaOH和Na2CO3 B. NaOH
C. Na2CO3 D. NaOH、Na2O2和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是( )

A. Mg和Al的总质量为8g B. 硫酸的物质的量浓度为5mol/L
C. NaOH溶液的物质的量浓度为5mol/L D. 生成的H2在标准状况下的体积为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下图所示A、B、C、D四种仪器,写出名称:
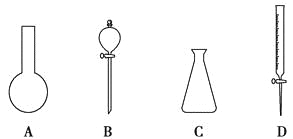
A. ,B. ,
C. ,D. 。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺,可使仪器不漏液或不漏气。在下列仪器中:①试管;②分液漏斗;③细口试剂瓶;④广口试剂瓶;⑤集气瓶;⑥滴瓶;⑦酸式滴定管;⑧碱式滴定管,肯定用不到“磨砂”处理的有 (填序号)。
(3)以下是中学化学实验中常见的定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平
①其中标有仪器使用温度的是 (填编号)。
②实验时用来精确量取液体体积的是 (填编号)。
③使用前要检查仪器是否漏液的是 (填编号)。
(4)玻璃棒的作用主要有以下四种:①搅拌、②引流、③蘸取溶液、④转移固体。不同实验中其作用可能不完全相同,请回答下列问题:
A.在“用无水碳酸钠配制100 mL 0.12 mol·L-1的碳酸钠溶液”的实验中,玻璃棒的作用是 (填写编号)。
B.在“用氢氧化钠溶液、碳酸钠溶液、氯化钡溶液、盐酸、水等试剂除去粗盐中的Mg2+、Ca2+、SO42-等杂质离子以制得纯净的食盐”的实验中玻璃棒的作用可能是 (填写编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上真空炼铷的原理为2RbCl+Mg![]() MgCl2+2Rb(g),下列说法正确的是( )
MgCl2+2Rb(g),下列说法正确的是( )
A.镁的金属活动性比铷强,故镁可置换铷
B.铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C.MgCl2的热稳定性比RbCl弱
D.Rb单质比RbCl更稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com