
【题目】工业上由黄铜矿(主要成分为 CuFeS2)冶炼铜的主要流程如下。下列说法不正确的是
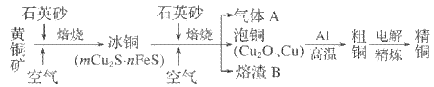
A. 气体A中的大气污染物可用氨水吸收并回收利用
B. 由泡铜冶炼粗铜的化学方程式为3Cu2O+2Al ![]() Al2O3+6Cu
Al2O3+6Cu
C. 加入石英砂作为添加剂熔剂,生成更稳定、更容易分离的硅酸盐
D. 用过量稀H2SO4可全部溶解熔渣B
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】最早使用的化学电池是锌锰电池,即大家熟悉的干电池,其结构如图所示。

尽管这种电池的历史悠久,但对于它的化学过程人们尚未完全了解。一般认为,放电时,电池中的反应如下:
E极:2MnO2+2e-+2NH4+===Mn2O3+H2O+2NH3↑
F极:Zn-2e-===Zn2+
总反应式:2MnO2+Zn+2NH4+===Mn2O3+Zn2++2NH3↑+H2O
下列说法正确的是
A.E极是电池的正极,发生的是氧化反应
B.F极是电池的负极,发生的是氧化反应
C.从结构上分析,锌锰电池应属于可充电电池
D.锌锰电池内部发生的氧化还原反应是可逆的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G7种物质的转化关系如下:
(1)A+B→C+H2O (2)C+KOH→D↓(蓝色)+E
(3) B+D→C+H2O (4)E+BaCl2→KCl + F↓(白色,不溶于稀硝酸)
(5)G+B→CO2↑+F↓+H2O,反应中B与CO2的物质的量之比为1:2
根据上述变化关系填空:
(1)请写出下列物质的化学式:B___;C___;F___;G___。
(2)检验E中的阴离子的实验是___。
(3)往G的溶液中滴加过量的KOH,反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M在模拟酶用于可视化生物硫醇检验中起到重要的作用,结构简式如下图。有关M的说法不正确的是
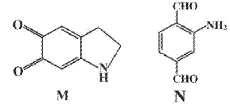
A. 分子式为C8H7NO2
B. 可发生取代反应、加成反应、氧化反应
C. 分子中所有碳原子都在同一平面上
D. 有机物N是M的同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,美国正在研究的锌电池可能取代目前广泛使用的铅酸蓄电池。锌电池具有容量大、污染少等优点。电池反应为2Zn+O2=2ZnO,原料为锌粒、电解液和空气。下列叙述正确的是( )
A. 锌为正极,空气进入负极反应B. 负极反应为Zn+2OH--2e-=ZnO+H2O
C. 正极发生氧化反应D. 电解液可以是乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、SO![]() 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
称取粗盐![]()
![]()
![]()
![]()
![]() 滤液
滤液![]()
![]() 精盐
精盐
(1)第①步中,操作A是________,第⑤步中,操作B是________。
(2)第④步中,写出相应的化学方程式(假设粗盐溶液中Ca2+的主要存在形式为CaCl2)_______。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是__________________。
(4)判断BaCl2已过量的方法是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+、Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
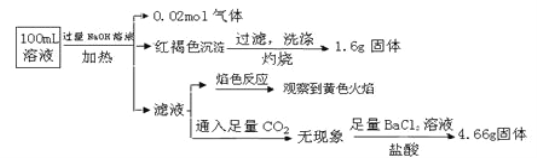
下列说法正确的是( )
A. 原溶液中c(Fe3+)=0.2 molL-1
B. 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol·L-1
C. SO42-、NH4+、Na+、CO32-一定存在,Cl-可能存在
D. 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的恒容密闭容器中发生反应xA(g)+ yB(g)![]() zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系;则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系;则下列结论正确的是

A. 图II所知反应xA(g)+yB(g) ![]() zC(g) △H<0,且a=2
zC(g) △H<0,且a=2
B. 200℃时,该反应的平衡常数为25
C. 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol/(Lmin)
D. 当外界条件由200℃降温到100℃,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在恒容密闭容器中进行,达到平衡状态的标志是
2NO+O2在恒容密闭容器中进行,达到平衡状态的标志是
①单位时间生成n mol O2,同时生成2n mool NO ②单位时间内生成n mol O2,同时生成2n mol NO2 ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1 ④混合气体的颜色不再改变 ⑤混合气体的密度不再改变 ⑥混合气体的平均相对分子质量不再改变
A. ①③⑤ B. ②④⑥ C. ②③④ D. ③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com