
【题目】在容积为2L的恒容密闭容器中发生反应xA(g)+ yB(g)![]() zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系;则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系;则下列结论正确的是

A. 图II所知反应xA(g)+yB(g) ![]() zC(g) △H<0,且a=2
zC(g) △H<0,且a=2
B. 200℃时,该反应的平衡常数为25
C. 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol/(Lmin)
D. 当外界条件由200℃降温到100℃,平衡正向移动
【答案】B
【解析】
A.由图Ⅱ可知,n(A)∶n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,即△H>0,故A错误;B、由图可知平衡时A、B、C的物质的量分别为0.4mol、0.2mol、0.2mol,A、B、C物质的量的变化量分别为:0.4mol、0.2mol、0.2mol,所以反应的化学方程式为2A(g)+B(g)C(g),平衡时A、B、C的浓度分别为:0.2mol/L、0.1mol/L、0.1mol/L,平衡常数K=![]() L2/mol2=25L2/mol2,故B正确;C.由图Ⅰ可知,200℃时5min达到平衡,平衡时B的物质的量变化量为0.4mol-0.2mol=0.2mol,故v(B)=
L2/mol2=25L2/mol2,故B正确;C.由图Ⅰ可知,200℃时5min达到平衡,平衡时B的物质的量变化量为0.4mol-0.2mol=0.2mol,故v(B)=![]() =0.02molL-1min-1,故C错误;D、根据图II可知,升高温度,C的体积分数增大,平衡正向移动,所以正反应为吸热反应,所以降低温度平衡逆向移动,故D错误;故选B。
=0.02molL-1min-1,故C错误;D、根据图II可知,升高温度,C的体积分数增大,平衡正向移动,所以正反应为吸热反应,所以降低温度平衡逆向移动,故D错误;故选B。


科目:高中化学 来源: 题型:
【题目】氢气、铝、铁都是重要的还原剂,已知下列反应的热化学方程式,下列关于反应的焓变判断正确的是
2H2(g)+O2(g)===2H2O(g) △H1
3H2(g)+Fe2O3(s)===2Fe (s)+ 3H2O(g) △H2
2Fe(s)+ 3/2O2(g)===Fe2O3(s) △H3
2Al(s)+3/2O2(g)===Al2O3(s) △H4
2Al(s)+ Fe2O3(s)===Al2O3(s)+2Fe(s) △H5
A. △H1<0;△H3>0 B. △H5<0;△H4<△H3
C. △H1=△H2+△H3 D. △H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分为 CuFeS2)冶炼铜的主要流程如下。下列说法不正确的是
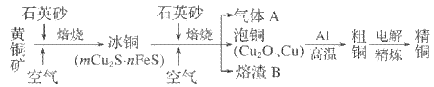
A. 气体A中的大气污染物可用氨水吸收并回收利用
B. 由泡铜冶炼粗铜的化学方程式为3Cu2O+2Al ![]() Al2O3+6Cu
Al2O3+6Cu
C. 加入石英砂作为添加剂熔剂,生成更稳定、更容易分离的硅酸盐
D. 用过量稀H2SO4可全部溶解熔渣B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
写出CO与H2反应生成CH4和H2O的热化学方程式____________
已知: CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
C(s)+2H2(g)![]() CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g)![]() C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式________________________ 。
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1_________P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)___________v(逆)(填“大于”、“小于”或“等于”)。
2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1_________P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)___________v(逆)(填“大于”、“小于”或“等于”)。

(4)以二氧化钛表面覆盖CuAl2O4为催化剂,可以将CH4和CO2直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是________________。
②为了提高该反应中CH4的转化率,可以采取的措施是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋为第五周期VA族元素,利用湿法冶金从辉铋矿(含Bi2S3、Bi、Bi2O3等)提取金属铋的工艺流程如下图所示:
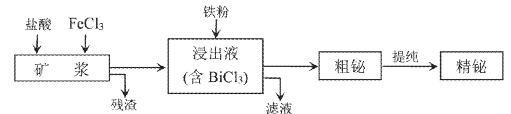
已知:BiCl3水解的离子方程式为:BiCl3+H2O![]() BiOCl+2H++2Cl-。
BiOCl+2H++2Cl-。
(1)矿浆浸出时加入盐酸的作用是___________。
(2)浸出时,Bi溶于FeCl3溶液的化学方程式为___________。
(3)残渣中含有一种单质,该单质是___________。
(4)滤液的主要溶质是(化学式)___________,该物质可在工艺中转化为循环利用的原料,转化的反应方程式为___________。
(5)精辉铋矿中含有Ag2S,被氧化溶解后不会进入浸出液,银元素以___________(填化学式)进入残渣中。
(6)粗铋提纯时,粗铋应放在___________极,阴极的电极反应式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某同学设计如图所示装置探究氯气能否与水发生反应。气体a的主要成分是含有少量水蒸气的氯气。请回答下列问题:


(1)气体a由右图甲或乙制备 ,若选用图中的甲装置,反应的离子方程式是_____,若选用装置乙,其中的导管 a 的作用是_____。
(2)证明氯气和水发生反应的实验现象为_____________。
(3)该实验设计存在缺陷,为了克服该缺陷,需要补充装置D,其中发生反应的离子方程式为_________________。
II.如图为浓硫酸与铜反应及其产物检验的实验装置

回答下列问题:
(1)指出试管c中产生的实验现象:______________________。
(2) 用可抽动的铜丝代替铜片的优点___________。
(3)写出浓硫酸与铜反应的化学方程式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。
(1)+6价的Cr能引起细胞的突变而对人体不利,可用亚硫酸钠将其还原。离子反应方程式为:3SO32-+Cr2O72-+8H+===2Cr3++3SO42-+4H2O,该反应氧化剂和还原剂的物质的量之比为___________。
(2)工业上利用铬铁矿( FeO. Cr2O3)冶炼铬的工艺流程如图所示:
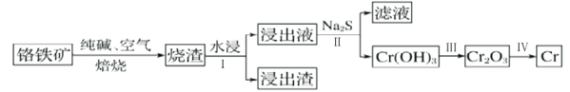
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是___________。
②水浸Ⅰ要获得浸出液的操作是___________。
③浸出液的主要成分为Na2CrO4,加入Na2S反应后有Na2SO4生成,则操作Ⅱ发生反应的离子方程式为___________。
(3)常温下Cr(OH)3的溶度积Ksp=1×10-32,若要使Cr3+完全沉淀pH为___________[c(Cr3+)降至10-5mol·L-1可认为完全沉淀]。
(4)以铬酸钠(Na2CrO4)为原料,用电化学法可制备重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2CrO42-+2H+=Cr2O72-+H2O)。
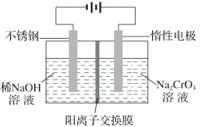
①阳极的电极反应式为___________。
②电解一段时间后,测得阳极区溶液中Na+物质的量由amol变为bmol,则生成重铬酸钠的物质的量为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。


据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应 B. 白磷比红磷稳定
C. S(g)+O2(g)===SO2(g) ΔH1S(s)+O2(g)=SO2(g) ΔH2 则ΔH1>ΔH2 D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L、体积分别为Va和Vb的HA溶液与BOH 溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH 的关系如图所示。下列说法正确的是
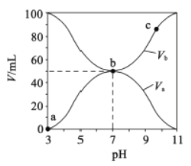
A. 由图可知BOH 一定是强碱 B. Ka(HA)=1×10-6mol/L
C. b点时,c(B-)=c(A-)=c(OH-)=c(H+) D. a→b过程中水的电离程度始终增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com