
【题目】铋为第五周期VA族元素,利用湿法冶金从辉铋矿(含Bi2S3、Bi、Bi2O3等)提取金属铋的工艺流程如下图所示:
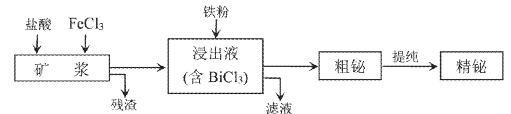
已知:BiCl3水解的离子方程式为:BiCl3+H2O![]() BiOCl+2H++2Cl-。
BiOCl+2H++2Cl-。
(1)矿浆浸出时加入盐酸的作用是___________。
(2)浸出时,Bi溶于FeCl3溶液的化学方程式为___________。
(3)残渣中含有一种单质,该单质是___________。
(4)滤液的主要溶质是(化学式)___________,该物质可在工艺中转化为循环利用的原料,转化的反应方程式为___________。
(5)精辉铋矿中含有Ag2S,被氧化溶解后不会进入浸出液,银元素以___________(填化学式)进入残渣中。
(6)粗铋提纯时,粗铋应放在___________极,阴极的电极反应式___________。
【答案】抑制BiCl3水解 Bi+3FeCl3=BiCl3+3FeCl2 S FeCl2 2FeCl2 +Cl2=2FeCl3 AgCl 阳 Bi3++3e-=Bi
【解析】
(1)矿浆浸出时溶液中BiCl3,BiCl3易发生水解,故加入HCl抑制BiCl3水解;
(2)浸出时,Bi溶于FeCl3发生氧化还原反应生成BiCl3和FeCl2;
(3)矿浆和HCl、FeCl3作用,负二价硫元素被氧化为S,所以生成硫单质;
(4)因在浸出液中加入Fe,所以Fe和BiCl3反应生成FeCl2和单质Bi,FeCl2溶液通入氯气将FeCl2氧化成FeCl3,转化为循环利用的原料FeCl3;
(5)在氧化溶解精辉铋矿的溶液中含有盐酸,所以银元素以AgCl形式进入残渣中;
(6)应用电解池原理进行粗铋提纯,粗铋做阳极,纯铋做阴极,溶液中的铋离子得到电子而析出;
(1)矿浆浸出液中BiCl3,BiCl3易发生水解,故加入HCl抑制BiCl3水解;
本题答案为:抑制BiCl3水解。
(2)浸出时,Bi溶于FeCl3发生氧化还原反应生成BiCl3和FeCl2,化学方程式为:Bi+3FeCl3=BiCl3+3FeCl2;
本题答案为:Bi+3FeCl3=BiCl3+3FeCl2。
(3)矿浆中Bi2S3和FeCl3反应时,负二价硫元素被氧化为S,所以生成硫单质;
本题答案为:S。
(4)因在浸出液中加入Fe,所以Fe和BiCl3反应生成FeCl2和单质Bi,故滤液的主要溶质是FeCl2,FeCl2转化为循环利用的FeCl3,化学方程式为:2FeCl2 +Cl2=2FeCl3;
本题答案为:FeCl2,2FeCl2 +Cl2=2FeCl3。
(5)精辉铋矿中含有Ag2S,被氧化溶解后不会进入浸出液,因为在氧化溶解精辉铋矿的溶液中含有大量的氯离子,所以银元素转化为难溶于水的AgCl进入残渣中;
本题答案为:AgCl。
(6)应用电解池原理进行粗铋提纯,粗铋做阳极,纯铋做阴极,溶液中的铋离子得到电子而析出;阴极电极反应式为:Bi3++3e-=Bi;
本题答案为:阳,Bi3++3e-=Bi。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】已知:①![]() ;
;
② 苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
以下是用苯作原料制备一系列化合物的转化关系图:

(1)A转化为B的化学方程式是_________________________。
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:
①________________,②____________________。
(3)苯的二氯代物有__________种同分异构体。
(4)有机物 的所有原子_______(填“是”或“不是”)在同一平面上。
的所有原子_______(填“是”或“不是”)在同一平面上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,美国正在研究的锌电池可能取代目前广泛使用的铅酸蓄电池。锌电池具有容量大、污染少等优点。电池反应为2Zn+O2=2ZnO,原料为锌粒、电解液和空气。下列叙述正确的是( )
A. 锌为正极,空气进入负极反应B. 负极反应为Zn+2OH--2e-=ZnO+H2O
C. 正极发生氧化反应D. 电解液可以是乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
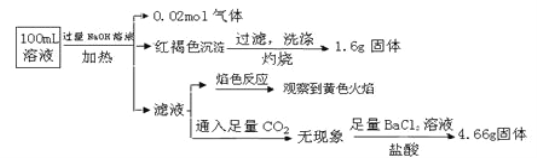
【题目】某溶液中可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+、Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
下列说法正确的是( )
A. 原溶液中c(Fe3+)=0.2 molL-1
B. 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol·L-1
C. SO42-、NH4+、Na+、CO32-一定存在,Cl-可能存在
D. 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.5 L某浓度的NaCl溶液中含有0.5 mol NaCl,下列对该溶液的说法中,不正确的是
A. 该溶液溶质的物质的量浓度为1 mol·L-1
B. 该溶液中含有58.5 g NaCl
C. 配制100 mL该溶液需用5.85 g NaCl
D. 量取100 mL该溶液倒入烧杯中,烧杯中的NaCl物质的量为0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的恒容密闭容器中发生反应xA(g)+ yB(g)![]() zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系;则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系;则下列结论正确的是

A. 图II所知反应xA(g)+yB(g) ![]() zC(g) △H<0,且a=2
zC(g) △H<0,且a=2
B. 200℃时,该反应的平衡常数为25
C. 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol/(Lmin)
D. 当外界条件由200℃降温到100℃,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源丰富,海水水资源的利用和海水化学资源(主要为NaCl和MgSO4及K、Br等元素)的利用具有非常广阔的前景。
(1)利用海水可以提取溴和镁,提取过程如下:

①提取溴的过程中,经过2次Br- → Br2转化的目的是_____,吸收塔中发生反应的离子方程式是________,
②从MgCl2溶液中得到MgCl2.6H2O晶体的主要操作是__________、_________、过滤、洗涤、干燥。
(2)![]()
①灼烧过程中用到的实验仪器有铁三角架、酒精灯、坩埚钳、_____、______。
②操作①中需用到玻璃棒,则玻璃棒的作用是_______________。
③向酸化后的水溶液加入适量3% H2O2溶液,发生反应的化学方程式为________。
④操作③是分液,则操作②是___________;操作④是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)![]() pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是

A.T1<T2 p1>p2 m+n>p 放热反应
B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应
D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体,图 1 表示各物质浓度随时间的变化,图 2 表示速率随时间的变化,t2、t3、t4、t5 时刻各改变一种条件,且改变的条件均不同。若t4时刻 改变的条件是压强,则下列说法错误的是

A.若 t1=15 s,则前 15 s 的平均反应速率 v(C)=0.004 mol·L-1·s-1
B.该反应的化学方程式为 3A(g)![]() B(g)+2C(g)
B(g)+2C(g)
C.t2、t3、t5 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D.若 t1=15 s,则 B 的起始物质的量为 0.04 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com