
����Ŀ��(1)ij�¶��£���2m g 16%��CuSO4��Һ�м���m g CuSO45H2O����Һǡ�ôﵽ���ͣ��ñ�����Һ��CuSO4����������Ϊ_____��
(2)��״���£�1���ˮ���ܽ�V���HCl���壬������Һ���ܶ�Ϊ��g/cm3����������Һ���ʵ�����������ʾΪ_____�����ʵ����ʵ���Ũ�ȱ�ʾΪ_____��
(3)������1����2�ֱ��ʾŨ��Ϊa molL��1��b molL��1������Һ�����ʵ�������������֪ 2a��b���������ƶ���ȷ����(������Һ���ܶȱȴ�ˮ�Ĵ�)_____(�����)
A. 2��1����2 B. ��2��2��1 C. ��2��2��1 D. ��1����2��2��1
(4)������1����2�ֱ��ʾŨ��Ϊa molL��1��b molL��1��ˮ�����ʵ�������������֪2��1����2���������ƶ���ȷ����(��ˮ���ܶȱȴ�ˮ��С)_____(�����)
A. 2a��b B. 2a��b C. 2a��b D. a��b��2a��
���𰸡�32% ![]()
![]() BD CD
BD CD
��������
(1)��������=![]() ��
��
(2) ��������=![]() �����ʵ���Ũ��c=
�����ʵ���Ũ��c=![]() ��
��
(3)�����Ũ��Խ���ܶ�Խ����![]() �жϦ�2����1�Ĺ�ϵ��
�жϦ�2����1�Ĺ�ϵ��
(4)��ˮ��Ũ��Խ���ܶ�ԽС������![]() �ж�a��b�Ĺ�ϵ��
�ж�a��b�Ĺ�ϵ��
(1) m(CuSO4)= 2m��16%��m ��![]() =0.96m g��CuSO4��Һ��������2m+m=3m g ����������=
=0.96m g��CuSO4��Һ��������2m+m=3m g ����������=![]() =
=![]() 32%��
32%��
(2)����1���Ϊ1L����״���£� V���HCl��������ʵ�����![]() mol������Ϊ
mol������Ϊ![]() ��36.5g ��������Һ����Ϊ
��36.5g ��������Һ����Ϊ![]() ��36.5g+1000g����Һ���Ϊ
��36.5g+1000g����Һ���Ϊ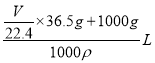 ����������Һ���ʵ�����������ʾΪ(
����������Һ���ʵ�����������ʾΪ(![]() ��36.5g)��(
��36.5g)��(![]() ��36.5g+1000g) ��100%=
��36.5g+1000g) ��100%=![]() �����ʵ����ʵ���Ũ�ȱ�ʾΪ
�����ʵ����ʵ���Ũ�ȱ�ʾΪ![]() mol��
mol��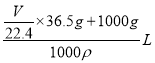 =
=![]() mol/L��
mol/L��
(3)����![]() ��a=
��a=![]() ��b=
��b=![]() ��2a��b��
��2a��b��![]() ��
�� ![]() �������Ũ��Խ���ܶ�Խ��
�������Ũ��Խ���ܶ�Խ��![]() �����Ԧ�2��2��1�����ʵ���Ũ��Խ����������Խ�����Ԧ�1����2��2��1����ѡBD��
�����Ԧ�2��2��1�����ʵ���Ũ��Խ����������Խ�����Ԧ�1����2��2��1����ѡBD��
(4)����![]() ����1=
����1=![]() ����2=
����2=![]() ��2��1����2��
��2��1����2��![]()
![]() ����ˮ��Ũ��Խ���ܶ�ԽС��
����ˮ��Ũ��Խ���ܶ�ԽС��![]() ������2a>b����������Խ�����ʵ���Ũ��Խ������a��b��2a����ѡCD��
������2a>b����������Խ�����ʵ���Ũ��Խ������a��b��2a����ѡCD��


 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д� �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д� �����ҵ�����������ѧ���ӳ�����ϵ�д�
�����ҵ�����������ѧ���ӳ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ֻ�л�ԭ�Ե�Ϊ�� ��
A.�������ƣ�Na2SO3��B.����C.HNO3D.����������FeSO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ��һ����Ҫ�ķ�Ӧ���ڹ�ũҵ�������ճ������ж��й㷺����;��
(1)��ҩ���й��ġ��Ĵ�����֮һ����Զֵ�������セ�����ڻ�ҩ�ڷ�����ըʱ���������·�Ӧ��2KNO3��3C��S=K2S��N2����3CO2�������б�������Ԫ����____________����ԭ������____________��
(2)ʵ����Ϊ�������й������ĺ�������������Ϳ��CuI����ֽ��������ֽ�Ƿ��ɫ����ɫ�����仯����ȥ��ʱ�����жϿ����еĺ��������䷴ӦΪ4CuI��Hg=Cu2HgI4��2Cu��
��������Ӧ����Cu2HgI4�У�CuԪ����________�ۡ�
�����Ϸ�Ӧ�е�������Ϊ________������1 mol CuI���뷴Ӧʱ��ת�Ƶ���________mol��
�۱���������Ӧ����ת�Ƶķ������Ŀ��____________________________��
(3)��ҵ�ϳ������Ը��������Һ��������CuS��Cu2S�Ŀ���䷴Ӧԭ�����£�
8MnO4����5Cu2S��44H��=10Cu2����5SO2����8Mn2����22H2O
6MnO4����5CuS��28H��=5Cu2����5SO2����6Mn2����14H2O
����������Ӧԭ����ijѧϰС����400 mL 0.075 mol��L��1�����Ը��������Һ����2 g����CuS��Cu2S�Ļ�����Ӧ�������Һ���Ͼ�SO2��ʣ���KMnO4ǡ����350 mL 0.1 mol��L��1��(NH4)2Fe(SO4)2��Һ��ȫ��Ӧ��
����ƽKMnO4��(NH4)2Fe(SO4)2��Ӧ�����ӷ���ʽ��______��MnO![]() ��Fe2����H��=Mn2����Fe3����H2O
��Fe2����H��=Mn2����Fe3����H2O
��KMnO4��Һ��������ﷴӦ��ʣ��KMnO4�����ʵ���Ϊ________ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Na2SO4��Fe2(SO4)3�Ļ����Һ����֪����Fe3�������ʵ���Ũ��Ϊ0.4 mol��L��1��SO42-�����ʵ���Ũ��Ϊ0.7 mol��L��1�������Һ��Na�������ʵ���Ũ��Ϊ(����)
A.0.1 mol��L��1B.0.15 mol��L��1
C.0.2 mol��L��1D.0.25 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧϰ���о���ѧ��һ����Ҫ���������з���������ǣ� ��
A.K2CO3��Na2O��������B.H2SO4��HNO3��������
C.KOH��Na2CO3�����ڼ�D.Na2O��Na2SiO3������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���ܱ������У��м���һ�������ɻ����ĸ��壬�������ֳ������֣�����߳���1molN2���ұ߳���8gCO��CO2�Ļ�����壬���崦����ͼ��ʾλ��(�����¶���ͬ)������������CO��CO2�������ʵ���Ϊ_____mol������CO��CO2�ķ�����֮��Ϊ_____��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧʽ��ָ�����ʵ���Ҫ�ɷֶ�Ӧ��ȷ���ǣ� ��
A.Si�����άB.NaHCO3��С�մ�
C.CaCO3����ʯ��D.KAl(SO4)2��12H2O���̷�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ȼ�������������в���ȷ����(����)
A. ��Ȼ������������Ҫ�ɷֶ��Ǽ���
B. ��Һ��ʯ����Ϊ��Ȼ��ȼ����ȼ��ʱӦ���ٽ����������������Ȼ����
C. ��Ȼ��ȼ�ϵķ�������SO2����Ⱦ��ĺ�����
D. ��Ȼ���������ϵ�ȼ�����ᷢ����ը
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵ�������ֵΪNA������˵����ȷ����
A. ��״���£�2.24LCH3OH�����й��ۼ�����ĿΪ0.5NA
B. 25��1LpH=12��Na2CO3��Һ�У���ˮ�����H+����ĿΪ0.01NA
C. 1molNa2O2������CO2��ַ�Ӧ��ת�Ƶĵ�����Ϊ2 NA
D. 0.1molH2��0.1molI2���ܱ������г�ַ�Ӧ��HI��������Ϊ0.2NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com