
【题目】关于天然气的下列叙述中不正确的是( )
A. 天然气和沼气的主要成分都是甲烷
B. 改液化石油气为天然气燃料,燃烧时应减少进空气量或增大进天然气量
C. 天然气燃料的废气中,SO2等污染物的含量少
D. 天然气与空气混合点燃,不会发生爆炸
科目:高中化学 来源: 题型:
【题目】为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验:
(1)若取a g样品,向其中加入足量的NaOH溶液,测得生成气体(标准状况,下同)的体积为b L。反应的化学方程式是_________________________________________________________;样品中铝的质量是________ g。
(2)若取a g样品将其点燃,恰好完全反应,该反应的化学方程式是__________________________________________________;氧化铁与铝的质量比是________。
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比c∶b=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度下,向2m g 16%的CuSO4溶液中加入m g CuSO45H2O,溶液恰好达到饱和,该饱和溶液中CuSO4的质量分数为_____。
(2)标准状况下,1体积水可溶解V体积HCl气体,所得溶液的密度为ρg/cm3,则所得溶液溶质的质量分数表示为_____,溶质的物质的量浓度表示为_____。
(3)若以ω1和ω2分别表示浓度为a molL﹣1和b molL﹣1硫酸溶液的溶质的质量分数,且知 2a=b,则下列推断正确的是(硫酸溶液的密度比纯水的大)_____(填序号)
A. 2ω1=ω2 B. ω2<2ω1 C. ω2>2ω1 D. ω1<ω2<2ω1
(4)若以ω1和ω2分别表示浓度为a molL﹣1和b molL﹣1氨水的溶质的质量分数,且知2ω1=ω2,则下列推断正确的是(氨水的密度比纯水的小)_____(填序号)
A. 2a=b B. 2a<b C. 2a>b D. a<b<2a.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+ B2= 2AB的能量变化如图所示,则下列说法正确的是( )

A. 该反应是吸热反应
B. 断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量
C. 断裂2 mol A—B键需要吸收y kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 向蒸馏水中滴加浓硫酸时,Kw不变
B. 常温下,0.005mol·L-1 Ba(OH)2溶液的pH=12
C. ![]() 的电离方程式:
的电离方程式:![]()
![]()
![]()
D. NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是425℃时,在1 L密闭容器中发生化学反应的浓度随时间的变化示意图。
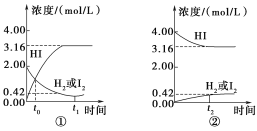
下列叙述错误的是( )
A. 图①中t0时,三种物质的物质的量相同
B. 图①中t0时,反应达到平衡状态
C. 图②中的可逆反应为2HI(g) ![]() H2(g)+I2(g)
H2(g)+I2(g)
D. 图①②中当c(HI)=3.16 mol/L时,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产、生活中广泛存在。
(1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:

写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:

①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
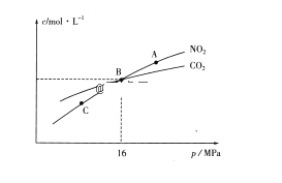
①A、C两点的浓度平衡常数关系:Kc(A)________Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是:

①一定有乙烯 ②一定有甲烷 ③一定有丙烷 ④一定没有乙烷⑤可能有甲烷 ⑥可能有乙炔(C2H2)
A. ②④ B. ②③⑥ C. ②⑥ D. ①③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com