
【题目】阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B. 25℃1LpH=12的Na2CO3溶液中,由水电离出H+的数目为0.01NA
C. 1molNa2O2与足量CO2充分反应,转移的电子数为2 NA
D. 0.1molH2和0.1molI2于密闭容器中充分反应后,HI分子总数为0.2NA
【答案】B
【解析】
A.标准状况下, CH3OH为液态,所以2.24LCH3OH分子不是0.1mol,故A错误;
B.25℃1LpH=12的Na2CO3溶液中,由于CO32-水解,所以溶液中的OH-都是水电离出来的,溶液中的c(OH-)等于水电离的c(H+),pH=12,c(OH-)=10-2mol/L,1L溶液中由水电离出H+的数目为0.01NA,故B正确;
C.在Na2O2![]() 2CO2= Na2CO3
2CO2= Na2CO3![]() O2,中,只有Na2O2中-1价的O化合价变化,1molNa2O2转移1mol电子,故C错误;
O2,中,只有Na2O2中-1价的O化合价变化,1molNa2O2转移1mol电子,故C错误;
D.H2![]() I2
I2![]() 2HI是可逆反应,不能进行到底,所以0.1molH2和0.1molI2于密闭容器中充分反应后,HI分子总数小于0.2NA,故D错误;
2HI是可逆反应,不能进行到底,所以0.1molH2和0.1molI2于密闭容器中充分反应后,HI分子总数小于0.2NA,故D错误;
本题答案为B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)某温度下,向2m g 16%的CuSO4溶液中加入m g CuSO45H2O,溶液恰好达到饱和,该饱和溶液中CuSO4的质量分数为_____。
(2)标准状况下,1体积水可溶解V体积HCl气体,所得溶液的密度为ρg/cm3,则所得溶液溶质的质量分数表示为_____,溶质的物质的量浓度表示为_____。
(3)若以ω1和ω2分别表示浓度为a molL﹣1和b molL﹣1硫酸溶液的溶质的质量分数,且知 2a=b,则下列推断正确的是(硫酸溶液的密度比纯水的大)_____(填序号)
A. 2ω1=ω2 B. ω2<2ω1 C. ω2>2ω1 D. ω1<ω2<2ω1
(4)若以ω1和ω2分别表示浓度为a molL﹣1和b molL﹣1氨水的溶质的质量分数,且知2ω1=ω2,则下列推断正确的是(氨水的密度比纯水的小)_____(填序号)
A. 2a=b B. 2a<b C. 2a>b D. a<b<2a.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是425℃时,在1 L密闭容器中发生化学反应的浓度随时间的变化示意图。
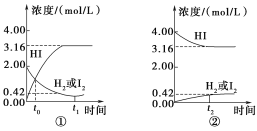
下列叙述错误的是( )
A. 图①中t0时,三种物质的物质的量相同
B. 图①中t0时,反应达到平衡状态
C. 图②中的可逆反应为2HI(g) ![]() H2(g)+I2(g)
H2(g)+I2(g)
D. 图①②中当c(HI)=3.16 mol/L时,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产、生活中广泛存在。
(1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:

写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:

①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
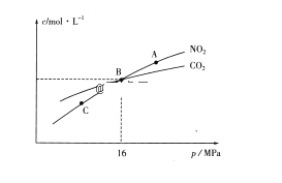
①A、C两点的浓度平衡常数关系:Kc(A)________Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于可逆反应的是( )
A. 2NO2=N2O4与N2O4=2NO2B. H2+I2 ![]() 2HI与2HI
2HI与2HI![]() H2+I2
H2+I2
C. CO2+H2O=H2CO3与H2CO3=CO2↑+H2OD. CaO+CO2=CaCO3与CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~J是中学化学中常见的物质,它们之间的转化关系如图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕固体,H的焰色呈黄色。

请回答下列问题:
(1)A物质的化学式为______________,H物质的名称为______________。
(2)G→J的实验现象是______________________________________________,化学方程式为____________________________。
(3)D与C高温下反应的化学方程式为____________________________。
(4)D物质与盐酸恰好反应的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析锌锰电池构造示意图,回答下列问题:
(1)普通锌锰电池的构造如图(a)所示。

①该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
②若电解质含有杂质Cu2+,会加速某电极的腐蚀。其主要原因是____________。
③普通锌锰电池的缺点有_____________。
(2)碱性锌锰电池的构造如图(b)所示。与普通锌锰电池相比,碱性锌锰电池的优点及其理由是_________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是:

①一定有乙烯 ②一定有甲烷 ③一定有丙烷 ④一定没有乙烷⑤可能有甲烷 ⑥可能有乙炔(C2H2)
A. ②④ B. ②③⑥ C. ②⑥ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取300 mL 0.2 mol/L的KI溶液与一定量的酸性 KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量为________________________。
(2)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,又变为棕黄色的原因用离子方程式解释________________________________________。
(3)在1 L FeBr2溶液中通入标准状况下2.24 L Cl2,溶液中有1/4的 Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_________________。
(4)三氟化氮(NF3)是一种无色、无臭的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请写出该反应的化学方程式_________________________________________,反应中生成0.2 mol HNO3,转移的电子数目为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com