
【题目】分析锌锰电池构造示意图,回答下列问题:
(1)普通锌锰电池的构造如图(a)所示。

①该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
②若电解质含有杂质Cu2+,会加速某电极的腐蚀。其主要原因是____________。
③普通锌锰电池的缺点有_____________。
(2)碱性锌锰电池的构造如图(b)所示。与普通锌锰电池相比,碱性锌锰电池的优点及其理由是_________________。

【答案】Zn(锌) 正极 锌与还原出来的铜构成铜锌原电池而加快锌的腐蚀 在使用过程中,锌会逐渐溶解,使锌外壳逐渐变薄;内部作电解质的糊状NH4Cl(显酸性)会泄漏出来,使电器腐蚀;即使不使用,放置过久,也会失效(答案合理即可) 碱性电池不易发生电解质的泄漏,因为消耗的负极改装在电池的内部;碱性电池使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高(答案合理即可)
【解析】
根据原电池的构成和工作原理解答即可。
①根据原电池原理,在干电池中,活泼金属锌作负极,电子由负极流向正极。答案:锌;正极。
②若电解质溶液中混有Cu2+,则Zn会置换出Cu,在原有电池的基础上又会形成Zn-Cu原电池,从而加速负极(锌)的腐蚀;答案:锌与还原出来的铜构成铜锌原电池而加快锌的腐蚀。
③普通锌锰电池的缺点有:在使用过程中,锌会逐渐溶解,使锌外壳逐渐变薄;内部作电解质的糊状NH4Cl(显酸性)会泄漏出来,使电器腐蚀;即使不使用,放置过久,也会失效(答案合理即可);答案:在使用过程中,锌会逐渐溶解,使锌外壳逐渐变薄;内部作电解质的糊状NH4Cl(显酸性)会泄漏出来,使电器腐蚀;即使不使用,放置过久,也会失效(答案合理即可)。
(2)与普通锌锰电池相比,碱性锌锰电池的优点及其理由是:碱性电池不易发生电解质的泄露,因为消耗的负极改装在电池的内部,碱性电池的使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高。答案:碱性电池不易发生电解质的泄漏,因为消耗的负极改装在电池的内部;碱性电池使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高(答案合理即可)。


科目:高中化学 来源: 题型:
【题目】下列化学式与指定物质的主要成分对应正确的是( )
A.Si—光导纤维B.NaHCO3—小苏打
C.CaCO3—熟石灰D.KAl(SO4)2·12H2O—绿矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2,排尽装置内的空气。

已知:在溶液中.FeSO4+NO![]() [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
A. 装置B、E中的试剂依次为水、硫酸亚铁溶液
B. 若观察到装置D中红色粉末变黑色,则NO与Cu发生了反应
C. 实验结束后,先关闭分液漏斗的活塞,再熄灭酒精灯
D. 装置F收集的气体中可能含有NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B. 25℃1LpH=12的Na2CO3溶液中,由水电离出H+的数目为0.01NA
C. 1molNa2O2与足量CO2充分反应,转移的电子数为2 NA
D. 0.1molH2和0.1molI2于密闭容器中充分反应后,HI分子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质子数的2倍。据此回答下列问题:
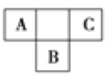
(1)A的气态氢化物的化学式为_________。
(2)B的元素符号为__________,在周期表中位于___________________。
(3)C的单质的化学式为__________,其氢化物的水溶液可用于雕刻玻璃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,其中X原子最外层电子数是内层电子数的两倍,元素Y的核电荷数等于W原子的最外层电子数,Z在空气中燃烧发出耀眼的白光。下列说法正确的是
A. X和Y的氧化物都是可导致酸雨的污染物
B. Z和W形成的化合物中既有离子键又有共价键
C. 最高价氧化物对应水化物的酸性由强到弱的顺序:W、Y、X
D. 原子半径由大到小的顺序:r(X)>r(Y)>r(Z)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6□+8H2O 。下列说法不正确的是
A. □处的物质应为KCl B. 每转移1mole- ,可以得到33g K2FeO4
C. 该反应中铁元素的化合价升高 D. 氧化性:Cl2>K2FeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是五种短周期元素。已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等。甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子。
物质组成 | 甲 | 乙 | 丙 | 丁 |
化合物中各元素 原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
请回答下列问题:
(1)元素E在周期表中的位置为___________________________;
(2)把D的单质放到NaOH溶液中,反应的化学方程式为:_______________________;
(3)用电子式表示甲的形成过程:_________________________;
(4)在密闭容器中充入BC2、BC和乙的混合气体共mg,若加入足量Na2O2,充分振荡并不断用电火花点燃至反应完全,测得固体质量增重mg,则BC2与乙的体积比为________________;
(5)有200mL MgCl2和丙的混合溶液,其中c(Mg2+)= 0.2 mol· L-1,c(Cl-)= 1.3mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4 mol·L-1 NaOH 溶液的体积是:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,甲容器有一个移动活塞,能使容器保持恒压。起始时向甲中充入2 mol SO2、1 mol O2,向乙中充入4mol SO2、2 mol O2。甲、乙的体积都为1L(连通管体积忽略不计).保持相同温度和催化剂存在的条件下,.关闭活塞K,使两容器中各自发生下述反应:2 SO2(g)+O2(g)![]() 2SO3(g)。达平衡时,甲的体积为0.8L。下列说法正确的是
2SO3(g)。达平衡时,甲的体积为0.8L。下列说法正确的是

A.乙容器中SO2的转化率小于60%
B.平衡时SO3的体积分数:甲>乙
C.打开K后一段时间.再次达到平衡.甲的体积为1.4 L
D.平衡后向甲中再充入2mol SO2、1mol O2和3moLSO3,平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com