
【题目】A、B、C、D、E是五种短周期元素。已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等。甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子。
物质组成 | 甲 | 乙 | 丙 | 丁 |
化合物中各元素 原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
请回答下列问题:
(1)元素E在周期表中的位置为___________________________;
(2)把D的单质放到NaOH溶液中,反应的化学方程式为:_______________________;
(3)用电子式表示甲的形成过程:_________________________;
(4)在密闭容器中充入BC2、BC和乙的混合气体共mg,若加入足量Na2O2,充分振荡并不断用电火花点燃至反应完全,测得固体质量增重mg,则BC2与乙的体积比为________________;
(5)有200mL MgCl2和丙的混合溶液,其中c(Mg2+)= 0.2 mol· L-1,c(Cl-)= 1.3mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4 mol·L-1 NaOH 溶液的体积是:______。
【答案】第三周期第VIIA族2Al+2NaOH+2H2O = 2NaAlO2+3H2↑![]() 1:180 mL
1:180 mL
【解析】
A、B、C、D、E是五种短周期元素,它们的原子序数依次增大,A是元素周期表中原子半径最小的元素,则A氢元素;B原子最外层电子数比其次外层电子数多2,则B碳元素,D的族序数与周期数相等,且D的原子序数大于B,同D为铝元素,D和E的原子序数之和为30,则E为氯元素,C是E的邻族元素,即为第ⅥA族元素,且原子序数介于B、D之间,则C为氧元素,甲分子中含有18个电子,根据表格中各物质中的原子个数比可知,甲为双氧水,乙为甲烷,丙为氯化铝,丁为四氯化碳,据此进行答题。
(1)E为氯元素,原子序数为17,位于周期表中第三周期,第VIIA族,故答案为:第三周期,第VIIA族;
(2)把铝的单质放到NaOH溶液中,反应的化学方程式为:2Al+2NaOH+2H2O = 2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O = 2NaAlO2+3H2↑;
(3)甲为双氧水,双氧水为共价化合物,形成过程用电子式表示为![]() ,故答案为:
,故答案为:![]()
![]() ;
;
(4)由2CO2+2Na2O2═2Na2CO3+O2可知,固体增重为与CO2等物质的量的CO的质量,由2Na2O2+2H2O=4NaOH+O2,可知固体增重为与H2O等物质的量的H2的质量,在密闭容器中充入CO2、CO、CH4的混合气体共mg,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体质量增加mg,则系列反应后CO2、CO、CH4混合气体中所有元素均被吸收,故原混合物中CO2与CH4相对于CO、H2混合,则CO2与CH4的体积之比为1:1,故答案为:1:1;
(5)有200mLMgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2molL-1,c(Cl-)=1.3molL-1,则c(Al3+)=0.3molL-1,要使Mg2+全部转化为沉淀分离出来,此时Al3+要生成AlO2-,需要NaOH物质的量为0.3×0.2×4+0.2×0.2×2mol=0.32mol,所以NaOH溶液的体积为![]() =0.08L=80mL,故答案为:80mL。
=0.08L=80mL,故答案为:80mL。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列物质中,都不能与Ag(NH3)2OH溶液发生银镜反应的一组是( )
①福尔马林;②蚁酸;③甲酸乙酯;④乙酸甲酯;⑤甲酸钠;⑥醋酸;⑦葡萄糖;⑧蔗糖;⑨麦芽糖
A.①②③④ B.④⑥⑧ C.⑦⑧⑨ D.⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴是人体必需的微量元素,含钴化合物作为颜料,具有悠久的历史,在机械制造、磁性材料等领域也具有广泛的应用,请回答下列问题:
(1)Co基态原子的电子排布式为__________________________;
(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学中的光敏剂、催化剂等方面得到广泛的应用,其结构如图所示,中心离子为钴离子。
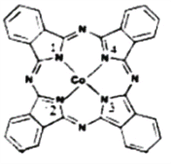
①酞菁钴中三种非金属原子的电负性有大到小的顺序为____________,(用相应的元素符号作答);碳原子的杂化轨道类型为___________________________;
②与钴离子通过配位健结合的氮原子的编号是___________________________;
(3)用KCN处理含Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN)6]4-,该配离子中的配位体为________,配位原子为____________________;
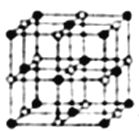
(4)Co的一种氧化物的晶胞如图所示,在该晶体中与一个钴原子等距离且最近的钴原子有_____个;与一个钴原子等距离且次近的氧原子有______个;若该钴的氧化物晶体中钴原子与跟它最近邻的氧原子之间的距离为r,该钴原子与跟它次近邻的氧原子之间的距离为______;已知在该钴的氧化物晶体中钴原子的半径为apm,氧原子的半径为bpm,它们在晶体中是紧密接触的,则在该钴的氧化物晶体中原子的空间利用率为____(用含a、b的式子表示)。
(5)筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接4个不同的原子或原子团,则这种碳原子称为“手性碳原子”。凡有一个手性碳原子的物质一定具有光学活性。物质如图所示,有光学活性,它发生下列反应后生成的有机物有光学活性的是:( )
![]()
A. 与NaOH溶液共热
B. 与乙酸发生酯化反应
C. 与银氨溶液发生银镜反应
D. 在催化剂存在下与H2作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途或相关性质的说法中,不正确的是:
A. 聚乙烯可用于制食品袋
B. 通信产业中用晶体硅来生产光导纤维
C. 氢氧化铝、碳酸镁、小苏打等可用于治疗胃酸过多
D. 液氨可用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构简式如图所示。下列叙述正确的是( )

A. 迷迭香酸与溴单质只能发生取代反应
B. 1 mol迷迭香酸最多能和9 mol氢气发生加成反应
C. 迷迭香酸可以发生水解反应、取代反应和酯化反应
D. 1 mol迷迭香酸最多能和5 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法正确的是 ( )
A.物质所含元素化合价升高的反应是还原反应
B.还原剂中必定有某种元素被氧化
C.物质中某元素失去电子,则此物质是氧化剂
D.在氧化还原反应中,失去电子的元素化合价降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 用玻璃棒蘸取某溶液进行焰色反应实验,火焰呈黄色 | 溶液中含有Na+ |
B | 向浓度均为0.1 mol·L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀。 | Ksp[Fe(OH)3]<Ksp[Al(OH)3] |
C | 室温下,用pH试纸测得:0.1 mol·L-1Na2CO3溶液的pH约为11;0.1 mol·L-1NaHCO3溶液的pH约为8。 | HCO3-结合H+的能力比CO32-的强 |
D | 用Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别清洗做完银镜反应的试管,FeCl3溶液清洗得干净 | 存在可逆过程: Fe3++Ag |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com