
【题目】以下说法正确的是 ( )
A.物质所含元素化合价升高的反应是还原反应
B.还原剂中必定有某种元素被氧化
C.物质中某元素失去电子,则此物质是氧化剂
D.在氧化还原反应中,失去电子的元素化合价降低
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是( )
A.H2SO4=2H++S6++4O2-B.NaHCO3=Na++H++CO32-
C.Ba(OH)2=Ba2++2OH-D.Na2CO3=Na2++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是五种短周期元素。已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等。甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子。
物质组成 | 甲 | 乙 | 丙 | 丁 |
化合物中各元素 原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
请回答下列问题:
(1)元素E在周期表中的位置为___________________________;
(2)把D的单质放到NaOH溶液中,反应的化学方程式为:_______________________;
(3)用电子式表示甲的形成过程:_________________________;
(4)在密闭容器中充入BC2、BC和乙的混合气体共mg,若加入足量Na2O2,充分振荡并不断用电火花点燃至反应完全,测得固体质量增重mg,则BC2与乙的体积比为________________;
(5)有200mL MgCl2和丙的混合溶液,其中c(Mg2+)= 0.2 mol· L-1,c(Cl-)= 1.3mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4 mol·L-1 NaOH 溶液的体积是:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质的电离方程式:
H2CO3_________________;
NaHCO3_________________;
K2SO4___________________;
NH4NO3__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,一种烷烃A和一种单烯烃B组成混合气体,A 或B 分子均最多只含有4 个碳原子,且B 分子的碳原子数比A 分子的多。将1升该混合气体充分燃烧,在同温同压下得到2.5升CO2气体。120℃时取1 升该混合气体与9 升氧气混和,充分燃烧后,当恢复到120℃和燃烧前的压强时,体积增大6.25%。则A 和B 的分子式分别为( )
A. C2H6、C4H8 B. C2H6、C3H6
C. CH4、C4H8 D. CH4、C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛、铁、镓、砷的单质及其化合物在生产生活中有重要的应用。回答下列问题;
(1)写出As的基态原子的电子排布式_________________________。
(2)N、P、As为同一主族元素,其电负性由大到小的顺序为_________________________,它们的氢化物沸点最高的是___________,原因为____________________________。
(3)Fe3+、Co3+与N3-、CN-等可形成络合离子。
①K3[Fe(CN)6]可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为_________________。
②[Co(N3) (NH3)5]SO4中Co的配位数为________________,其配离子中含有的化学键类型为______(填离子键、共价键、配位键),C、N、O的第一电离能最大的为_______________,其原因是__________________________。
(4)砷化镓晶胞结构如下图。晶胞中Ga与周围等距且最近的As形成的空间构型为_____________。已知砷化镓晶胞边长为apm,其密度为ρg·cm-3,则阿伏加德罗常数的数值为_______(列出计算式即可)。
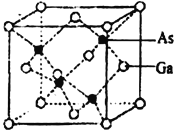
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨反应:N2+3H2 ![]() 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、N≡N1mol键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、N≡N1mol键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可___(填“吸收”或“放出”)热量___kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是_______________________。
(3)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为_____mol/(L·min)。
(4)一定条件下,当合成氨反应达到化学平衡时,下列说法正确的是________
A.正反应速率和逆反应速率相等 B.正反应速率最大,逆反应速率为0
C.N2的转化率达到最大值 D.N2和H2的浓度相等
E.N2、H2和NH3的体积分数相等 F.反应达到最大限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关一些有机物的相关叙述正确的是:
A. 苯滴入溴水中因发生取代反应而使溴水褪色
B. 乙酸和乙醇都能使紫色石蕊试液变红
C. 所有的有机物都易溶于有机溶剂而不溶于水
D. 乙烯通入到溴水中因发生加成反应而使溴水褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com