
【题目】在有机物分子中,若某个碳原子连接4个不同的原子或原子团,则这种碳原子称为“手性碳原子”。凡有一个手性碳原子的物质一定具有光学活性。物质如图所示,有光学活性,它发生下列反应后生成的有机物有光学活性的是:( )
![]()
A. 与NaOH溶液共热
B. 与乙酸发生酯化反应
C. 与银氨溶液发生银镜反应
D. 在催化剂存在下与H2作用
 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】H7N9型禽流感是一种新型禽流感,浙江自2015年入秋以来,已累计报告人感染H7N9禽流感4例。研究表明,该病毒对热敏感,煮沸2分钟以上即可失去活性,许多常用消毒药物如:高锰酸钾、漂白粉、氯气等,也都可以将该病毒杀灭。
(1)新制氯水中含有多种微粒,将紫色石蕊试液滴入氯水中,溶液显红色起作用的微粒是___________;过一会儿,溶液颜色逐渐褪去,起作用的微粒是______________。
请写出氯气与水反应的离子方程式_____________________。
(2)工业上制取漂白粉的反应方程式为:__________________。
(3)已知高锰酸钾与浓盐酸混合能产生氯气,化学反应方程式为:2KMnO4 + 16HCl ![]() 2MnCl2 + 2KCl + 8H2O + 5Cl2↑,该反应中氧化剂为____________。
2MnCl2 + 2KCl + 8H2O + 5Cl2↑,该反应中氧化剂为____________。
(4)向漂白粉清液中滴加碳酸钠溶液,有白色沉淀生成,写出发生反应的离子方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究 Fe3+和 Cu2+对 H2O2 分解反应的催化效果,甲、乙两组同学分别设计了如图1、图 2所示的实验。下列叙述中不正确的是( )
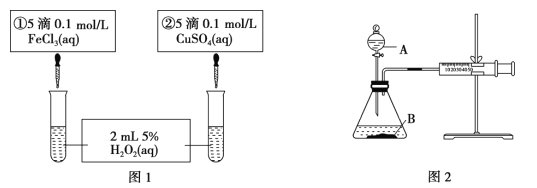
A. 图 1 实验可通过观察产生气泡的快慢来比较反应速率的大小
B. 若图 1 所示实验速率为①>②,则一定能说明 Fe3+比 Cu2+对 H2O2 分解催化效果好
C. 用图 2 装置比较反应速率,可测定相同时间相同状况产生气体体积的多少进行比较
D. 图 2 中将注射器活塞拉出一定距离,一段时间后松开活塞,能返回原处,则不漏气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)为第VIA元素,其单质凭借优良的性能成为制作合金添加剂、半导体、光电元件的主体材料,并被广泛应用于冶金、航空航天、电子等领域。可从精炼铜的阳极泥(主要成分为Cu2Te)中回收碲,
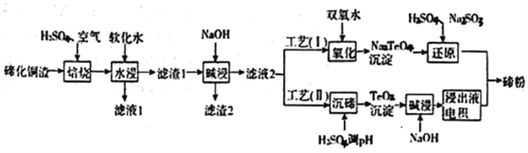
(1)“培烧”后,确主要以TeO2形式存在,写出相应反应的离子方程式:________________________。
(2)为了选择最佳的培烧工艺进行了温度和硫酸加入量的条件试验,结果如下表所示:
温度/℃ | 硫酸加入量(理论量倍数) | 浸出率/% | |
Cu | Te | ||
450 | 1.25 | 77.3 | 2.63 |
460 | 1.00 | 80.29 | 2.81 |
1.25 | 89.86 | 2.87 | |
1.50 | 92.31 | 7.70 | |
500 | 1.25 | 59.83 | 5.48 |
550 | 1.25 | 11.65 | 10.63 |
则实验中应选择的条件为_________________,原因为______________________________。
(3)滤渣1在碱浸时发生的化学方程式为_____________________________。
(4)工艺(I)中,“还原”时发生的总的化学方程式为____________________________。
(5)由于工艺(I)中“氧化”对溶液和物料条件要求高。有研究者采用工艺(II)获得磅.则“电积”过程中,阴极的电极反应式为____________________________________。
(6)工业生产中,滤渣2经硫酸酸浸后得滤液3和滤渣3。
①滤液3与滤液1合井。进入铜电积系统。该处理措施的优点为_____________________________。
②滤渣3中若含Auspan>和Ag,可用_____将二者分离。(填字母)
A.王水 B.稀硝酸 C.浓氢氧化钠溶液 D.浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为_____ (填放热,吸热,无法确定 )反应。
②下列措施能用勒夏特列原理解释是_____(填序号)。
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应式_____。
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=_____(用ab表示)。
(4)原料气H2可通过反应 CH4(g)+H2O (g)![]() CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:

①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会__(填“增大”,“减小”减小,“不变”不变)。
(5)原料气H2还可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08molL﹣1,该温度下反应的平衡常数K值为_____。
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是五种短周期元素。已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等。甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子。
物质组成 | 甲 | 乙 | 丙 | 丁 |
化合物中各元素 原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
请回答下列问题:
(1)元素E在周期表中的位置为___________________________;
(2)把D的单质放到NaOH溶液中,反应的化学方程式为:_______________________;
(3)用电子式表示甲的形成过程:_________________________;
(4)在密闭容器中充入BC2、BC和乙的混合气体共mg,若加入足量Na2O2,充分振荡并不断用电火花点燃至反应完全,测得固体质量增重mg,则BC2与乙的体积比为________________;
(5)有200mL MgCl2和丙的混合溶液,其中c(Mg2+)= 0.2 mol· L-1,c(Cl-)= 1.3mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4 mol·L-1 NaOH 溶液的体积是:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体的还原性,装置如图所示,下列说法不合理的是
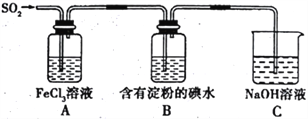
A. 为了验证A 中发生了氧化还原反应,加入稀盐酸酸化的BaCl2溶液,产生白色沉淀
B. 该实验装置至少存在一处设计缺陷
C. 向反应后的A 溶液中加入酸性KMnO4溶液,紫红色褪去,说明一定有Fe2+
D. 装置B是为了验证还原性: SO2>I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质的电离方程式:
H2CO3_________________;
NaHCO3_________________;
K2SO4___________________;
NH4NO3__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
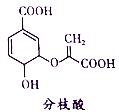
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com