
【题目】碲(Te)为第VIA元素,其单质凭借优良的性能成为制作合金添加剂、半导体、光电元件的主体材料,并被广泛应用于冶金、航空航天、电子等领域。可从精炼铜的阳极泥(主要成分为Cu2Te)中回收碲,
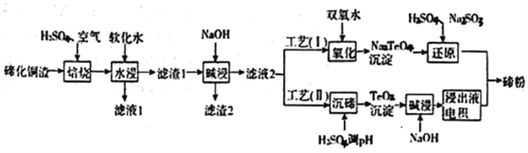
(1)“培烧”后,确主要以TeO2形式存在,写出相应反应的离子方程式:________________________。
(2)为了选择最佳的培烧工艺进行了温度和硫酸加入量的条件试验,结果如下表所示:
温度/℃ | 硫酸加入量(理论量倍数) | 浸出率/% | |
Cu | Te | ||
450 | 1.25 | 77.3 | 2.63 |
460 | 1.00 | 80.29 | 2.81 |
1.25 | 89.86 | 2.87 | |
1.50 | 92.31 | 7.70 | |
500 | 1.25 | 59.83 | 5.48 |
550 | 1.25 | 11.65 | 10.63 |
则实验中应选择的条件为_________________,原因为______________________________。
(3)滤渣1在碱浸时发生的化学方程式为_____________________________。
(4)工艺(I)中,“还原”时发生的总的化学方程式为____________________________。
(5)由于工艺(I)中“氧化”对溶液和物料条件要求高。有研究者采用工艺(II)获得磅.则“电积”过程中,阴极的电极反应式为____________________________________。
(6)工业生产中,滤渣2经硫酸酸浸后得滤液3和滤渣3。
①滤液3与滤液1合井。进入铜电积系统。该处理措施的优点为_____________________________。
②滤渣3中若含Auspan>和Ag,可用_____将二者分离。(填字母)
A.王水 B.稀硝酸 C.浓氢氧化钠溶液 D.浓盐酸
【答案】 Cu2Te+4H++2O2![]() 2Cu2++TeO2+2H2O 460℃,硫酸用量为理论量的1.25倍 该条件下,铜的浸出率高且碲的损失较低 ToO2+2NaOH=Na2TeO3+H2O Na2TeO4+3Na2SO3+H2SO4==4Na2SO4+Te+H2O TeO32-+ 4e-+3H2O=Te+6OH- CuSO4溶液回收利用,提高经济效益 B
2Cu2++TeO2+2H2O 460℃,硫酸用量为理论量的1.25倍 该条件下,铜的浸出率高且碲的损失较低 ToO2+2NaOH=Na2TeO3+H2O Na2TeO4+3Na2SO3+H2SO4==4Na2SO4+Te+H2O TeO32-+ 4e-+3H2O=Te+6OH- CuSO4溶液回收利用,提高经济效益 B
【解析】(1)Cu2Te在H2SO4条件下,与氧气在高温下反应生成TeO2和CuSO4,反应的离子方程式Cu2Te+4H++2O2![]() 2Cu2++TeO2+2H2O;正确答案:Cu2Te+4H++2O2
2Cu2++TeO2+2H2O;正确答案:Cu2Te+4H++2O2![]() 2 Cu2++TeO2+2H2O 。
2 Cu2++TeO2+2H2O 。
(2)从图表信息可知:当硫酸的量一定时,温度升高时,铜的浸出率降低;温度一定时,铜和Te的浸出率均增大。在460℃条件下,硫酸用量为理论量的1.25倍的条件下最佳,铜的浸出率高且Te 的损失较小;正确答案:460℃,硫酸用量为理论量的1.25倍;该条件下,铜的浸出率高且碲的损失较低。
(3)从流程可知,滤渣1为ToO2,它可与碱反应生成TeO32-;正确答案: ToO2+2NaOH=Na2TeO3+H2O。
(4)从流程图可知:Na2TeO4被Na2SO3还原为Te,而Na2SO3被氧化为Na2SO4,总反应方程式:Na2TeO4+3Na2SO3+H2SO4==4Na2SO4+Te+H2O;正确答案:Na2TeO4+3Na2SO3+H2SO4=4Na2SO4 +Te+H2O。
(5)根据反应ToO2+2NaOH=Na2TeO3+H2O,生成的TeO32-在阴极得电子被还原为Te,极反应方程式为:TeO32-+4e-+3H2O=Te+6OH- ;正确答案:TeO32-+4e-+3H2O=Te+6OH-。
(6)①工业生产中,滤渣2为少量的氢氧化铜固体,经硫酸酸浸后得滤液硫酸铜,滤液1中主要成分也为硫酸铜,滤液3与滤液1合并进入铜电积系统,提取金属铜,有效回收利用了硫酸铜,提高经济效益;正确答案:CuSO4溶液回收利用,提高经济效益。
②Au和Ag都与王水反应,与浓氢氧化钠溶液、.浓盐酸均不反应;但是Au与稀硝酸不反应而Ag可以反应,所以可以用稀硝酸将二者分离;正确答案: B。


科目:高中化学 来源: 题型:
【题目】铈是地壳中含量最高的稀土元素,二氧化铈(CeO2)是其重要的化合物。平板液晶显示屏生产过程中产生大量的废玻璃粉末,其中含CeO2、SiO2、Fe2O3等物质,某实验小组以此粉末为原料回收铈,设计流程如图所示:
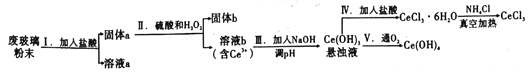
(1)步骤Ⅰ加入过量盐酸后,溶液a中的阳有离子___________________。
(2)步骤Ⅱ中反应的氧化剂和还原剂的物质的量之为___________。
(3)为了使步骤Ⅲ所得悬浊液中的Ce3+浓度为1×10-6mol·L-1,则加入NaOH调节溶液的pH应为____________[已知:Ce(OH)3的Ksp=8.0×10-21,lg2=0.3]。
(4)将NH4Cl固体与CeCl3·6H2O混合真空加热可得无水CeCl3,其中加入NH4Cl的作用是__________。
(5)第Ⅴ步反应的化学方程式是____________________;用反应得到的悬浊液制备纯净的Ce(OH)4需进行的实验操作为______________。
(6)对CeCl3样品纯度进行测定的方法:准确称取样品wg配成100mL溶液,取25.00mL置于锥形瓶中,加入稍过量的过二硫酸铵[(NH4)2S2O8]溶液将Ce3+氧化为Ce4+,然后用萃取剂[用(HT2)表示]萃取Ce4+,再用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(其离子反应方程式为Ce4++Fe2+=Ce3++Fe3+),重复2~3次,平均消耗VmL标准溶液。
①“萃取”时存在反应:Ce4++n(HT)2![]() Ce(H2n-4)+4H+,若要提高滴定的准确率,应使溶液呈______性(填“酸”“中”或“碱”)。
Ce(H2n-4)+4H+,若要提高滴定的准确率,应使溶液呈______性(填“酸”“中”或“碱”)。
②经计算,CeCl3样品的纯度为________________。 [M(CeCl3)=246.5g·mol-1]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 对于A(s)+B(g) ![]() C(g)+D(g)的反应,加入A,反应速率加快
C(g)+D(g)的反应,加入A,反应速率加快
B. 2NO2![]() N2O4(正反应放热),升高温度,v(正)增大,v(逆)减小
N2O4(正反应放热),升高温度,v(正)增大,v(逆)减小
C. 一定温度下,反应 N2(g)+3H2(g) ![]() 2NH3(g)在密闭容器中进行,恒压,充入He不改变化学反应速率
2NH3(g)在密闭容器中进行,恒压,充入He不改变化学反应速率
D. 100 mL2 mol·L—1稀盐酸与锌反应时,加入少量硫酸铜固体,生成氢气的速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃,分别向10ml浓度均为1mol/L的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。所得溶液pH的两倍(2pH)与溶液浓度的对数(1gc)的关系如图所示。下列叙述正确的是
己知:(1)HA的电离平衡常数Ka=[c(H+)·c(A-)]/[c(HA)-c(A-)]≈c2(H+)/c(HA);(2)pKa=-lgKa

A. 弱酸的Ka随溶液浓度的降低而增大
B. a点对应的溶液中c(HA)=0.1mol/L,pH=4
C. 酸性:HA<HB
D. 弱酸HB的pKa=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴是人体必需的微量元素,含钴化合物作为颜料,具有悠久的历史,在机械制造、磁性材料等领域也具有广泛的应用,请回答下列问题:
(1)Co基态原子的电子排布式为__________________________;
(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学中的光敏剂、催化剂等方面得到广泛的应用,其结构如图所示,中心离子为钴离子。
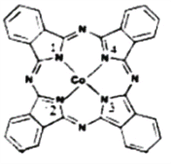
①酞菁钴中三种非金属原子的电负性有大到小的顺序为____________,(用相应的元素符号作答);碳原子的杂化轨道类型为___________________________;
②与钴离子通过配位健结合的氮原子的编号是___________________________;
(3)用KCN处理含Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN)6]4-,该配离子中的配位体为________,配位原子为____________________;
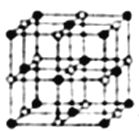
(4)Co的一种氧化物的晶胞如图所示,在该晶体中与一个钴原子等距离且最近的钴原子有_____个;与一个钴原子等距离且次近的氧原子有______个;若该钴的氧化物晶体中钴原子与跟它最近邻的氧原子之间的距离为r,该钴原子与跟它次近邻的氧原子之间的距离为______;已知在该钴的氧化物晶体中钴原子的半径为apm,氧原子的半径为bpm,它们在晶体中是紧密接触的,则在该钴的氧化物晶体中原子的空间利用率为____(用含a、b的式子表示)。
(5)筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接4个不同的原子或原子团,则这种碳原子称为“手性碳原子”。凡有一个手性碳原子的物质一定具有光学活性。物质如图所示,有光学活性,它发生下列反应后生成的有机物有光学活性的是:( )
![]()
A. 与NaOH溶液共热
B. 与乙酸发生酯化反应
C. 与银氨溶液发生银镜反应
D. 在催化剂存在下与H2作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构简式如图所示。下列叙述正确的是( )

A. 迷迭香酸与溴单质只能发生取代反应
B. 1 mol迷迭香酸最多能和9 mol氢气发生加成反应
C. 迷迭香酸可以发生水解反应、取代反应和酯化反应
D. 1 mol迷迭香酸最多能和5 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在多电子原子里,把电子运动的能量不同的区域简化为不连续的壳层称作为电子层。电子层模型被称为洋葱式结构,如图所示:
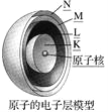
根据电子层模型,判断下列说法不正确的是( )
A. 多电子原子的核外电子是分层运动的
B. 所有电子在同一区域里运动
C. 排在K、L、M层上的电子的能量依次增大
D. 多电子原子里电子的能量不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com