
【题目】在多电子原子里,把电子运动的能量不同的区域简化为不连续的壳层称作为电子层。电子层模型被称为洋葱式结构,如图所示:
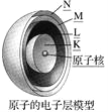
根据电子层模型,判断下列说法不正确的是( )
A. 多电子原子的核外电子是分层运动的
B. 所有电子在同一区域里运动
C. 排在K、L、M层上的电子的能量依次增大
D. 多电子原子里电子的能量不同
科目:高中化学 来源: 题型:
【题目】碲(Te)为第VIA元素,其单质凭借优良的性能成为制作合金添加剂、半导体、光电元件的主体材料,并被广泛应用于冶金、航空航天、电子等领域。可从精炼铜的阳极泥(主要成分为Cu2Te)中回收碲,
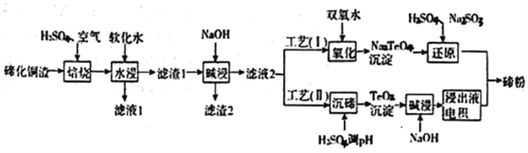
(1)“培烧”后,确主要以TeO2形式存在,写出相应反应的离子方程式:________________________。
(2)为了选择最佳的培烧工艺进行了温度和硫酸加入量的条件试验,结果如下表所示:
温度/℃ | 硫酸加入量(理论量倍数) | 浸出率/% | |
Cu | Te | ||
450 | 1.25 | 77.3 | 2.63 |
460 | 1.00 | 80.29 | 2.81 |
1.25 | 89.86 | 2.87 | |
1.50 | 92.31 | 7.70 | |
500 | 1.25 | 59.83 | 5.48 |
550 | 1.25 | 11.65 | 10.63 |
则实验中应选择的条件为_________________,原因为______________________________。
(3)滤渣1在碱浸时发生的化学方程式为_____________________________。
(4)工艺(I)中,“还原”时发生的总的化学方程式为____________________________。
(5)由于工艺(I)中“氧化”对溶液和物料条件要求高。有研究者采用工艺(II)获得磅.则“电积”过程中,阴极的电极反应式为____________________________________。
(6)工业生产中,滤渣2经硫酸酸浸后得滤液3和滤渣3。
①滤液3与滤液1合井。进入铜电积系统。该处理措施的优点为_____________________________。
②滤渣3中若含Auspan>和Ag,可用_____将二者分离。(填字母)
A.王水 B.稀硝酸 C.浓氢氧化钠溶液 D.浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质的电离方程式:
H2CO3_________________;
NaHCO3_________________;
K2SO4___________________;
NH4NO3__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
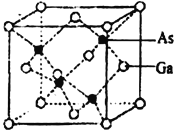
【题目】钛、铁、镓、砷的单质及其化合物在生产生活中有重要的应用。回答下列问题;
(1)写出As的基态原子的电子排布式_________________________。
(2)N、P、As为同一主族元素,其电负性由大到小的顺序为_________________________,它们的氢化物沸点最高的是___________,原因为____________________________。
(3)Fe3+、Co3+与N3-、CN-等可形成络合离子。
①K3[Fe(CN)6]可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为_________________。
②[Co(N3) (NH3)5]SO4中Co的配位数为________________,其配离子中含有的化学键类型为______(填离子键、共价键、配位键),C、N、O的第一电离能最大的为_______________,其原因是__________________________。
(4)砷化镓晶胞结构如下图。晶胞中Ga与周围等距且最近的As形成的空间构型为_____________。已知砷化镓晶胞边长为apm,其密度为ρg·cm-3,则阿伏加德罗常数的数值为_______(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知三氯化铁的熔点为306℃,沸点为315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验:
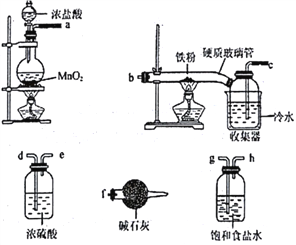
(1)装碱石灰的仪器是____________(填仪器名称),碱石灰的作用______________________。
(2)装置的连接顺序为_________________________。
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移
至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
![]()
①固体混合物的成分是_____________________。(填化学式)
②淡黄色溶液中加入试剂X生成淡红色溶液的离子反应方程式为_______________________________。
(4)已知红色褪去的同时有气体生成,经检验为O2。该小组内的同学们对红色褪去的原因提出了三种假设。
假设I:H2O2还原Fe3+,使其转变为Fe2+;
假设Ⅱ:H2O2分解生成O2,O2氧化试剂X;
假设Ⅲ:__________________________________。(如果表达中遇到试剂X,请写出其化学式)。
并对假设进行了以下实验研究:
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和BaCl2溶液,产生白色沉淀。
②另取同浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。 实验①说明假设__________不正确; 实验②的目的是_______________;由实验①②得出假设________是正确的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨反应:N2+3H2 ![]() 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、N≡N1mol键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、N≡N1mol键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可___(填“吸收”或“放出”)热量___kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是_______________________。
(3)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为_____mol/(L·min)。
(4)一定条件下,当合成氨反应达到化学平衡时,下列说法正确的是________
A.正反应速率和逆反应速率相等 B.正反应速率最大,逆反应速率为0
C.N2的转化率达到最大值 D.N2和H2的浓度相等
E.N2、H2和NH3的体积分数相等 F.反应达到最大限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
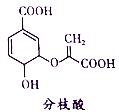
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 将2 mol NO和2 mol O2混合,充分反应后体系中原子总数为8NA
B. 将100 mL 0.1 mol·L﹣1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
C. CO2通过Na2O2使其增重a g时,反应中转移的电子数为![]() NA
NA
D. 100 g质量分数为9.8%的H2SO4水溶液中含氧原子数目为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com