
| A. | 干冰 | B. | 食盐 | C. | 碳化硅 | D. | 金刚石 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 将Na2O2加入含有Al3+、Fe2+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入Na2O2的物质的量(mol)的关系如图所示.下列说法不正确的是( )
将Na2O2加入含有Al3+、Fe2+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入Na2O2的物质的量(mol)的关系如图所示.下列说法不正确的是( )| A. | a=1.75 | |
| B. | b=0.5 | |
| C. | 原溶液中Al3+与Fe2+的物质的量之比为1:2 | |
| D. | 最后得到的沉淀为Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
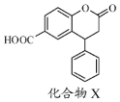
| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 不能与饱和Na2CO3溶液反应 | |
| C. | 1 mol化合物X最多能与2 molNaOH反应 | |
| D. | 在酸性条件下水解,水解产物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
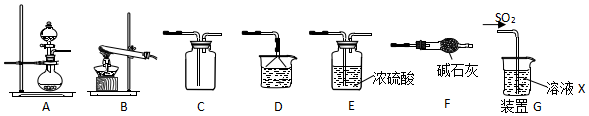
| 实验 | 操作 | 现象 | 结论和解释 |
| 2 | 将SO2通入0.1mol/LFeCl3和BaCl2混合液 | 产生白色沉淀 | Fe3+能氧化H2SO3 |
| 3 | 将SO2通入0.01mol/LHNO3 和 BaCl2混合液 | 产生白色沉淀 | 酸性条件NO3-能将H2SO3氧化为SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com