
| A. | Ba(OH)2 | B. | Na2S | C. | Ba(NO3)2 | D. | BaCl2 |
分析 二氧化硫为酸性氧化物,与碱、盐溶液等可发生反应,结合强酸制取弱酸的反应原理来解答,注意硝酸根离子在酸溶液中的氧化性分析,注意二氧化硫的氧化性,据此分析解答.
解答 解:A.二氧化硫为酸性氧化物,能够与氢氧化钡反应生成亚硫酸钡沉淀,故A不选;
B.二氧化硫有弱的氧化性,能够氧化硫离子生成硫单质,硫单质不溶于水,所以会产生沉淀,故B不选;
C.二氧化硫具有强的还原性,酸性环境下能够被硝酸根离子氧化生成硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡沉淀,故C不选;
D.盐酸的酸性大于亚硫酸,则二者不反应,一定不会产生沉淀,故D选;
故选:D.
点评 本题考查二氧化硫的化学性质,为高频考点,侧重强酸制取弱酸的反应原理及二氧化硫酸性氧化物性质的考查,注意酸性的比较及硅酸为不溶性酸,题目难度不大.


科目:高中化学 来源: 题型:解答题
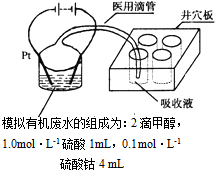 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、NaCl、NaAlO2 | B. | KNO3、NaCl、CH3COONa | ||
| C. | Na2S、(NH4)2SO3、AgNO3 | D. | Ba(NO3)2、FeSO4、NH4HCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠和水反应:Na+2H2O→Na++2OH-+H2↑ | |
| B. | 用氢氧化钠溶液吸收少量二氧化硫气体:SO2+2OH-→SO32-+H2O | |
| C. | 硫酸铵溶液和氢氧化钡溶液反应:Ba2++SO42-→BaSO4↓ | |
| D. | 醋酸和碳酸钙反应:2H++CaCO3→Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定管、容量瓶和分液漏斗使用前都要检漏、干燥 | |
| B. | 滴定管没有用标准液润洗,会导致测定结果偏高 | |
| C. | 滴定管中加标准液后,要调节液面位置在零刻度或以下 | |
| D. | 胆矾结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO | B. | Fe2O3 | C. | Fe3O4 | D. | Fe5O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
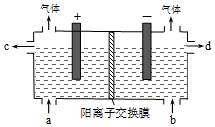 用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,下列叙述正确的是( )
用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,下列叙述正确的是( )| A. | 通电后阳极区溶液pH增大 | |
| B. | 阴极区的电极反应式为4OH--4e-=O2↑+2H2O | |
| C. | 当电路中通过1mol电子的电量时,会有0.25mol的Cl2生成 | |
| D. | 通电后Li+通过交换膜向阴极区迁移,LiOH浓溶液从d口导出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com