
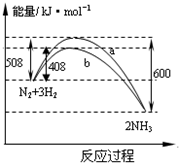
| A. | 该反应的热化学方程式为:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g)△H=-92kJ•mol-1 | |
| B. | 曲线b表明加入催化剂降低了反应热,加快了反应速率 | |
| C. | 加入催化剂,生成1molNH3的反应热减小50KJ | |
| D. | 不用催化剂,生成1molNH3放出的热量为46KJ |
分析 A.△H=吸收的能量-放出的能量,依据热化学方程式的书写原则判断;
B.催化剂可以加快反应速率,但是不影响反应热;
C.催化剂只能降低反应的活化能,不改变化学平衡分析;
D.催化剂不影响化学平衡,则不影响反应热.
解答 解:A.该反应放出的能量大于吸收的能量,所以为放热反应,书写热化学方程式要注意化学计量数与反应物物质的量的关系,该反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,故A错误;
B.加入催化剂降低了反应的活化能,反应速率加快,但是反应热不变,故B错误;
C.加入催化剂改变反应速率,不改变化学平衡,反应的热效应不变,故C错误;
D.催化剂对反应热大小无影响,根据选项A可知,生成2molNH3放出92kJ,所以生成 1molNH3放出的热量为46 KJ,故D正确;
故选D.
点评 本题考查了热化学方程式的书写及应用,题目难度不大,根据图象正确判断反应热为解答关键,注意催化剂只影响反应速率,不影响化学平衡,为易错点.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ②③⑤ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子的核外电子排布呈周期性变化 | |
| B. | 元素原子的最外层电子排布呈周期性变化 | |
| C. | 元素的化合价呈周期性变化 | |
| D. | 元素原子半径呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓HNO3的氧化性比稀HNO3,故有时在实验室看到的浓硝酸呈黄色 | |
| B. | Na的金属性比Mg强,故可用Na与MgCl2溶液反应制取Mg | |
| C. | Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中Fe也显+3价 | |
| D. | AlCl3易水解,故由AlCl3•6H2O制无水AlCl3应在HCl气流中加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室制乙烯通常采用95%的乙醇与浓硫酸(体积比为1:3)混合加热到170℃方法制得,其制备原理可表示如下:
实验室制乙烯通常采用95%的乙醇与浓硫酸(体积比为1:3)混合加热到170℃方法制得,其制备原理可表示如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | CH3CH2OH | B. | CH3CHO | C. | HCOOH | D. | CH3CH2CH2COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com