
| A. | 元素原子的核外电子排布呈周期性变化 | |
| B. | 元素原子的最外层电子排布呈周期性变化 | |
| C. | 元素的化合价呈周期性变化 | |
| D. | 元素原子半径呈周期性变化 |
分析 A、元素的性质由最外层电子决定;
B、随原子序数的递增,电子层数和最外层电子数都呈现周期性的变化而引起元素性质的周期性变化;
C、元素的最高正化合价的周期性变化是原子的电子排布周期性变化的结果;
D、元素的原子半径的周期性变化是原子的电子排布周期性变化的结果.
解答 解:A、应由最外层电子的排布决定化学性质,故A错误;
B、由原子的电子排布可知,随原子序数的递增,电子层数和最外层电子数都呈现周期性的变化而引起元素性质的周期性变化,即原子的电子层排布的周期性变化是引起元素性质周期性变化的决定因素,故B正确;
C、化合价属于元素的性质,元素的最高正化合价的周期性变化是原子的电子排布周期性变化的结果,故C错误;
D、元素的原子半径属于元素的性质,元素的原子半径的周期性变化是电子排布周期性变化的结果,故D错误.
故选B.
点评 随着原子序数的递增,元素原子的核外电子排布的周期性变化导致元素性质(金属性和非金属性,原子半径,化合价等)的周期性变化.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 正极反应式为KClO4(s)+8e?═KCl(s)+4O2?(l) | |
| B. | 在该热电池中,铁为负极,发生还原反应 | |
| C. | △H参与反应的高氯酸钾越多,其值越小 | |
| D. | 生成1 mol FeO转移8 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 图为制取纯净干燥的气体A的装置图的一部分.生成A的速度可通过滴入液体B的速度控制.已知A是一种无色、无气味的气体,它不能使酸碱指示剂变色,也不能在空气中燃烧,但能使带火星的木条复燃.
图为制取纯净干燥的气体A的装置图的一部分.生成A的速度可通过滴入液体B的速度控制.已知A是一种无色、无气味的气体,它不能使酸碱指示剂变色,也不能在空气中燃烧,但能使带火星的木条复燃.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
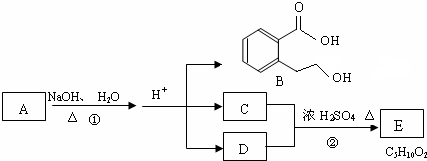
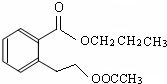 或
或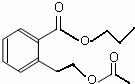 .
. .
.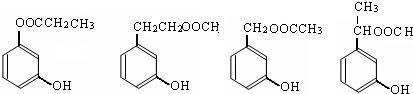 (写出四者之一即可).
(写出四者之一即可).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
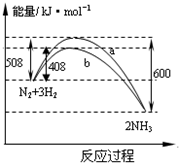
| A. | 该反应的热化学方程式为:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g)△H=-92kJ•mol-1 | |
| B. | 曲线b表明加入催化剂降低了反应热,加快了反应速率 | |
| C. | 加入催化剂,生成1molNH3的反应热减小50KJ | |
| D. | 不用催化剂,生成1molNH3放出的热量为46KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 物质 | SiCl4 | AlCl3 | FeCl3[来 | FeCl2 |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com