
 图为制取纯净干燥的气体A的装置图的一部分.生成A的速度可通过滴入液体B的速度控制.已知A是一种无色、无气味的气体,它不能使酸碱指示剂变色,也不能在空气中燃烧,但能使带火星的木条复燃.
图为制取纯净干燥的气体A的装置图的一部分.生成A的速度可通过滴入液体B的速度控制.已知A是一种无色、无气味的气体,它不能使酸碱指示剂变色,也不能在空气中燃烧,但能使带火星的木条复燃.分析 A是一种无色、无味、不能使酸碱指示剂变色、不会在空气中燃烧的气体,但能使带火星的木条复燃,应为氧气,图为固体与液体不加热条件下制备氧气,可为过氧化钠和水或过氧化氢在二氧化锰催化作用下生成,D为干燥装置,以此解答该题.
解答 解:(1)A是一种无色、无味、不能使酸碱指示剂变色、不会在空气中燃烧的气体,但能使带火星的木条复燃,应为氧气,
故答案为:O2;
(2)若C是一种淡黄色固体,能够制取氧气,则C为过氧化钠,过氧化钠和水反应方程式为:2Na2O2+2H2O=4NaOH+O2↑;
故答案为;2Na2O2+2H2O=4NaOH+O2↑;
(3)若C是一种黑色粉末,能够制取氧气,则C为二氧化锰,B为双氧水,二氧化锰起催化剂的作用;
故答案为:H2O2;催化剂;
(4)D中导管长进短出,应该盛装浓硫酸,起干燥剂作用,除去氧气中混有的少量水蒸气,
故答案为:浓硫酸;干燥剂.
点评 本题考查无机物推断、氧气制备实验,把握装置中发生的反应及装置的分析应用为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 屠呦呦女士利用乙醚萃取青蒿素获得了2015年度诺贝尔生理学或医学奖,为人类防治疟疾作出了重大贡献 | |
| B. | 光导纤维应避免在强碱性环境中使用 | |
| C. | 硅胶多孔、吸水能力强,常用作袋装食品的干燥 | |
| D. | 陶瓷、水泥、玻璃、大理石属于硅酸盐产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ${\;}_{8}^{18}$O,${\;}_{8}^{17}$O | B. | O2,O3 | C. | Fe3+,Fe2+ | D. | ${\;}_{6}^{12}$C,${\;}_{6}^{13}$C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
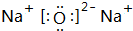 、
、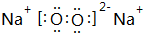 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子的核外电子排布呈周期性变化 | |
| B. | 元素原子的最外层电子排布呈周期性变化 | |
| C. | 元素的化合价呈周期性变化 | |
| D. | 元素原子半径呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH═CHCH2CH3 | B. | CH2═CHCH2CH2CH3 | ||
| C. | CH3CH═CHCH2CH2CH3 | D. | 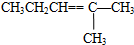 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓HNO3的氧化性比稀HNO3,故有时在实验室看到的浓硝酸呈黄色 | |
| B. | Na的金属性比Mg强,故可用Na与MgCl2溶液反应制取Mg | |
| C. | Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中Fe也显+3价 | |
| D. | AlCl3易水解,故由AlCl3•6H2O制无水AlCl3应在HCl气流中加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
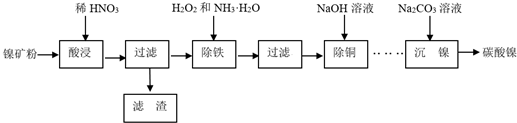
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | 将Fe3O4固体溶于HI溶液中:Fe3O4+8H+=2Fe3++Fe2++4H2O | |
| C. | 将氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 向FeBr2溶液中通入少量的氯气:2Br-+Cl2=2Cl-+Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com