
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | 将Fe3O4固体溶于HI溶液中:Fe3O4+8H+=2Fe3++Fe2++4H2O | |
| C. | 将氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 向FeBr2溶液中通入少量的氯气:2Br-+Cl2=2Cl-+Br2 |
分析 A.反应生成氯化铜、氯化亚铜,遵循电子、电荷守恒;
B.发生氧化还原反应生成碘化亚铁、碘、水;
C.反应生成的HClO在离子反应中保留化学式;
D.少量氯气,只氧化亚铁离子.
解答 解:A.用FeCl3溶液腐蚀铜线路板的离子反应为Cu+2Fe3+═Cu2++2Fe2+,故A正确;
B.将Fe3O4固体溶于HI溶液中的离子反应为2I-+Fe3O4+8H+=3Fe2++I2+4H2O,故B错误;
C.将氯气溶于水的离子反应为Cl2+H2O═H++Cl-+HClO,故C错误;
D.向FeBr2溶液中通入少量的氯气的离子反应为Fe2++Cl2=2Cl-+2Fe3+,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:解答题
 图为制取纯净干燥的气体A的装置图的一部分.生成A的速度可通过滴入液体B的速度控制.已知A是一种无色、无气味的气体,它不能使酸碱指示剂变色,也不能在空气中燃烧,但能使带火星的木条复燃.
图为制取纯净干燥的气体A的装置图的一部分.生成A的速度可通过滴入液体B的速度控制.已知A是一种无色、无气味的气体,它不能使酸碱指示剂变色,也不能在空气中燃烧,但能使带火星的木条复燃.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏是化学变化 | |
| B. | 煤液化后可以得到甲醇等液体燃料 | |
| C. | 煤中含有苯和甲苯,可以用蒸馏的方法把它们分离出来 | |
| D. | 从萃取分液后溴的四氯化碳溶液中提取溴可以用蒸馏的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 物质 | SiCl4 | AlCl3 | FeCl3[来 | FeCl2 |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
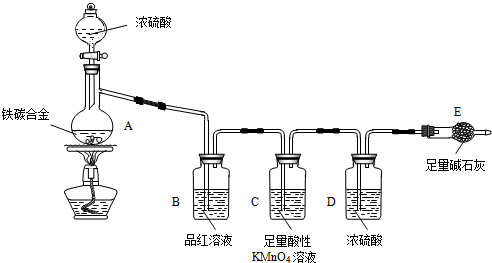
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
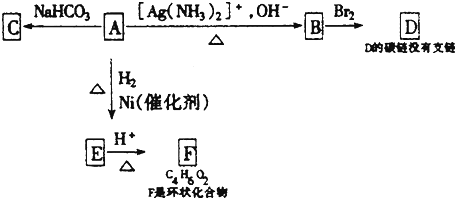
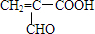 .
.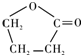 .由E生成F的反应类型是酯化反应.
.由E生成F的反应类型是酯化反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳的结构式:O-C-O | B. | 过氧化钠的电子式: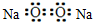 | ||
| C. | 丙烷分子的球棍模型: | D. | Cl-的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
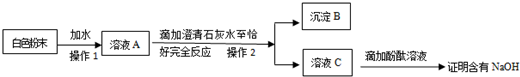
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com