
【题目】
(1)写出三个装置中所共同发生的两个反应的化学方程式: 、 ;
写出B盛AgNO3溶液的试管中所发生反应的化学方程式: 。
(2)装置A和C均采用了长玻璃导管,其作用是 。
(3)在按装置B、C装好仪器及药品后要使反应开始,应对装置B进行的操作是 ;
应对装置C进行的操作是 。
(4)B中采用了双球洗气管吸收装置,其作用是 ,反应后双球洗气管中可能出现的现象是 。
(5)B装置存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是 。
【答案】(1)2Fe+3Br2![]() 2FeBr3
2FeBr3
![]() +Br2
+Br2![]()
![]() +HBr
+HBr
HBr+AgNO3![]() AgBr↓+HNO3
AgBr↓+HNO3
(2)导气、冷凝
(3)打开分液漏斗盖子,旋转分液漏斗的活塞,使溴和苯的混合液滴到铁粉上 ;托起软橡胶袋使铁粉落入溴和苯组成的混合液中
(4)吸收随HBr逸出的苯蒸气、溴蒸气 ; CCl4由无色变成橙色
(5)随HBr逸出的溴蒸气和苯蒸气不能回流到反应器中,原料利用率低导管插入AgNO3溶液中而易产生倒吸
【解析】试题分析:(1)A、B、C三种装置都可制取溴苯,三个装置中都发生都会发生铁与溴的反应、苯与溴的取代反应,反应的化学方程式为2Fe+3Br2=2FeBr3, ;HBr与硝酸银反应生成溴化银反应生成浅黄色溴化银沉淀,方程式为:HBr+AgNO3=AgBr↓+HNO3,
;HBr与硝酸银反应生成溴化银反应生成浅黄色溴化银沉淀,方程式为:HBr+AgNO3=AgBr↓+HNO3,
故答案为:2Fe+3Br2=2FeBr3, ;HBr+AgNO3=AgBr↓+HNO3;
;HBr+AgNO3=AgBr↓+HNO3;
(2)苯和溴的取代反应中有溴化氢生成,苯和溴易挥发,所以导管b除导气外,还有起冷凝回流作用,减少苯和溴的挥发,
故答案为:导气(导出HBr)兼冷凝(冷凝苯和溴蒸气);
(3)苯和溴易挥发,并且有毒,苯与溴逸入空气会造成环境污染,故答案为:Br2和苯的蒸气逸出,污染环境;
(4)B装置中采用了双球吸收管,利用四氯化碳吸收反应中随HBr逸出的溴和苯的蒸气;反应后双球吸管中四氯化碳吸收了溴单质,溶液从无色变成了橙色;
故答案为:吸收反应中随HBr逸出的溴和苯的蒸气;CCl4由无色变橙色;
(5)随HBr逸出的溴蒸气和苯蒸气不能回流到反应器中,原料利用率低;由于导管插入AgNO3溶液中而容易产生倒吸,
故答案为:原料利用率低;容易产生倒吸.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作或方法能达到目的的是
A.用氨水除去试管内壁上的银镜
B.用分液的方法分离乙酸乙酯和乙醇的混合物
C.用点燃的方法鉴别乙醇、苯和四氯化碳
D.用溴水鉴别苯、甲苯和乙苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Z的百分含量与时间的关系如图2所示。则下列结论正确的是( )

A.容器中发生的反应可表示为3X(g)+Y(g) =2Z(g)
B.反应进行的前3 min内,用X表示的反应速率v(X)=0.2 mol/(L·min)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用一玻片盖在培养皿上。下表中对实验现象的描述或所作的解释错误的是( )

选项 | 实验现象 | 解 释 |
A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了硫单质 |
C | KMnO4溶液褪色 | SO2具有还原性 |
D | 品红溶液褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(16分)如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约为1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
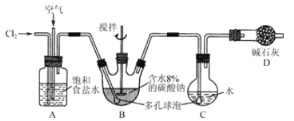
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8 ℃,42 ℃以上分解为Cl2和O2。
(1)① 实验中控制氯气与空气的体积比的方法是 。
② 为使反应充分进行实验中采取的措施有 。
(2)① 装置B中产生Cl2O的化学方程式为 。
② 若B无冷却装置,进入C中的Cl2O会大量减少。其原因是 。
(3)装置C中采用棕色圆底烧瓶是因为 。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中所得次氯酸溶液的物质的量浓度的实验方案为:用 量取20.00 mL次氯酸溶液, 。
(可选用的试剂有H2O2溶液、FeCl2溶液、AgNO3溶液。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com