
【题目】某课外活动小组,为研究金属的腐蚀和防护的原理,做了以下实验:将剪下的一块镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,按如图所示的装置进行实验,过一段时间后观察,下列现象不可能出现的是( )
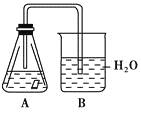
A.B中导气管中产生气泡B.B中导气管里形成一段水柱
C.金属片剪口变红D.锌被腐蚀
【答案】A
【解析】
镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,形成的原电池中,金属锌为负极,铁为正极,发生吸氧腐蚀,根据原电池的工作原理知识来回答即可。
镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,形成的原电池中,金属锌为负极,发生反应:Zn-2e-=Zn2+,铁为正极,发生吸氧腐蚀,即2H2O+O2+4e-=4OH-,所以锥形瓶中气体压强减小,生成的氢氧根离子遇到酚酞会显示红色;
A、原电池形成后没有气体生成,所以B中导气管不会产生气泡,故A错误;
B、锥形瓶中金属发生吸氧腐蚀,瓶中气体压强减小,导气管里形成一段水柱,故B正确;
C、锥形瓶中金属发生吸氧腐蚀,生成的氢氧根离子遇到酚酞会显示红色,故C正确;
D、形成的原电池中,金属锌为负极,发生反应: Zn-2e-=Zn2+,故D正确;
故答案选A。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】对于放热反应Zn+H2SO4=ZnSO4+H2↑,下列叙述正确的是( )
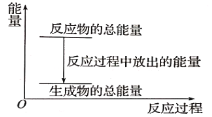
A. 反应过程中的能量关系可用上图表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则其能量转化形式为电能转化为化学能
D. 若将其设计为原电池,当有32.5gZn溶解时,正极放出的气体一定为11.2L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和氮及其化合物在生产生活中应用广泛。请回答:
(1)将SO2通入品红溶液中,现象为品红溶液________,加热后溶液颜色________。
(2)已知反应:SO2+Cl2+2H2O ═ 2HCl+H2SO4,该反应中的氧化产物是__________。
(3)木炭与浓硫酸共热的化学反应方程式为:C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O,若生成0.5 mol CO2,则转移电子的物质的量是_________mol。
CO2↑+2SO2↑+2H2O,若生成0.5 mol CO2,则转移电子的物质的量是_________mol。
(4)工业上可以通过氮气和氢气在一定条件下合成氨气。下列关于氨气的性质和用途描述正确的是____________。
A.氨气易液化,液氨可作制冷剂 B.可用排水法收集氨气
C.氨气是一种无色无味的气体 D.向氨水中滴加酚酞,溶液变红
(5)实验室检验试管里氨气是否收集满的方法是___________________(写出一种即可)。
(6)汽车尾气常含有NO、NO2、CO等,会污染空气。在汽车尾气排放管处安装一个催化转化器,可使尾气中有害气体CO和NO反应转化为两种无毒气体,该反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1mol·L-1 的 FeCl3 溶液呈___________性(填“酸”、“碱”或“中”),原因是___(请用离子方程式表示)。电子工业曾用 30%的 FeCl3溶液腐蚀敷有铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得到 FeCl3 溶液,设计如下实验流程:
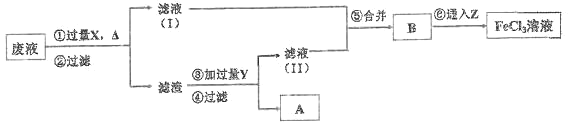
上述流程中,所加试剂的化学式为:X_____,Y_________,Z_____;第⑥步反应的离子方程 式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10℃时加热![]() 饱和溶液,测得该溶液的pH发生如下变化:
饱和溶液,测得该溶液的pH发生如下变化:

(1)![]() 饱和溶液中存在三个平衡关系,写出三个平衡表达式 :________;_______;______。
饱和溶液中存在三个平衡关系,写出三个平衡表达式 :________;_______;______。
(2)甲同学认为,该溶液的pH升高的原因是![]() 的水解程度增大,故碱性增强。乙同学认为,溶液的pH升高的原因是
的水解程度增大,故碱性增强。乙同学认为,溶液的pH升高的原因是![]() 受热分解,生成了
受热分解,生成了![]() ,并推断
,并推断![]() 的水解程度________(填“大于”或“小于”)
的水解程度________(填“大于”或“小于”)![]() 。丙同学认为将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则 ____________(填“甲”或“乙”)判断正确。
。丙同学认为将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则 ____________(填“甲”或“乙”)判断正确。
(3)丁同学向饱和![]() 溶液中加入饱和
溶液中加入饱和![]() 溶液,观察到有白色沉淀和无色气体,经检验该白色沉淀为碳酸钙沉淀,试利用沉淀溶解平衡表达式和K、Q关系分析产生该沉淀的原因 ____________。
溶液,观察到有白色沉淀和无色气体,经检验该白色沉淀为碳酸钙沉淀,试利用沉淀溶解平衡表达式和K、Q关系分析产生该沉淀的原因 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产含氯有机物时会产生HCl。
利用反应__HCl(g)+__O2(g)__Cl2(g)+__H2O(g)可实现氯的循环利用。
完成下列填空:
(1)配平该化学方程式,并标出电子转移的方向和数目。_____
(2)若将该反应设计成一原电池,则Cl2应在_____(填“正极”或“负极”)附近逸出。
(3)上述反应中所有元素原子半径由大到小的顺序为_____;与氯元素同族的短周期元素原子最外层电子排布式为____。
(4)判断氯、溴非金属性强弱的依据是____(选填序号)。
a.熔点:Cl2<Br2 b.氧化性:Cl2>Br2 c.热稳定性:HCl>HBr d.酸性:HCl<HBr
(5)上述反应若在固定体积的密闭容器中发生,能说明反应已达平衡的是__(选填序号)。
a.2v(HCl)正=v(Cl2)逆 b.体系压强不再改变
c.混合气体密度不变 d.![]() =K
=K
(6)若反应容器容积为2L,4molHCl与1molO2混合气体反应至8min时,测得容器内气体压强减小了10%,则用HCl表示的该反应的化学反应速率为___。
(7)图是在4种不同投料比下,温度对HCl平衡转化率影响的曲线(![]() =1,2,4,6)
=1,2,4,6)

①曲线a对应的投料比![]() ____。
____。
②不改变投料比,使曲线b达到曲线d相同的HCl平衡转化率,可采取的措施有____;____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述不正确的是( )

A.WZ的水溶液呈中性
B.元素非金属性的顺序为X< Y< Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是( )
为阿伏加德罗常数的值。下列说法正确的是( )
A.![]() 标准状况
标准状况![]() 氦气含有的质子数为
氦气含有的质子数为![]()
B.1mol氯气与足量的铁反应,转移电子数目为3NA
C.![]() 溶液中所含
溶液中所含![]() 的数目为
的数目为![]()
D.密闭容器中![]() 与
与![]() 充分反应,产物的分子数为
充分反应,产物的分子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应![]() ,在容积固定的密闭容器中达到平衡状态的标志是( )
,在容积固定的密闭容器中达到平衡状态的标志是( )
①单位时间内生成![]() 的同时生成
的同时生成![]()
②单位时间内生成![]() 的同时生成
的同时生成![]()
③用![]() 表示的反应速率之比为
表示的反应速率之比为![]() 的状态
的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的物质的量不再改变的状态
A.①④⑥⑦B.②③⑤⑦C.①③④⑤D.全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com