
【题目】常温下,0.1mol·L-1 的 FeCl3 溶液呈___________性(填“酸”、“碱”或“中”),原因是___(请用离子方程式表示)。电子工业曾用 30%的 FeCl3溶液腐蚀敷有铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得到 FeCl3 溶液,设计如下实验流程:
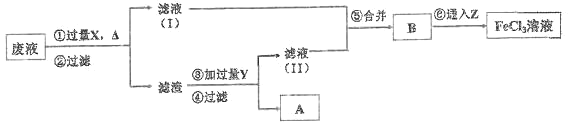
上述流程中,所加试剂的化学式为:X_____,Y_________,Z_____;第⑥步反应的离子方程 式为_____________________________。
【答案】酸 Fe3++3H2OFe(OH)3+3H+ Fe HCl Cl2 2Fe2++Cl2=2Fe3++2Cl
【解析】
FeCl3为强酸弱碱盐,铁离子水解,促进水的电离,水解离子反应方程式为:Fe3++3H2OFe(OH)3+3H+,使其溶液呈酸性;废液中含有FeCl2和CuCl2,向废液中加入Fe,Fe置换出Cu,然后过滤,得到的滤渣中含有Fe、Cu,滤液中含有FeCl2,向滤渣中加入稀盐酸,Fe和稀盐酸反应生成FeCl2,然后过滤,得到的固体A是Cu;滤液中含有HCl和FeCl2,将滤液I、II合并,通入过量氯气,将氯化亚铁转化为氯化铁,
通过以上分析知,X是Fe、Y是HCl、Z是Cl2,第⑥步反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl,
故答案为:酸;Fe3++3H2OFe(OH)3+3H+;Fe;HCl;Cl2;2Fe2++Cl2=2Fe3++2Cl。


科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是( )
A.碳酸氢铵溶液中加入足量的浓氢氧化钠溶液并加热:NH4++OH- =NH3↑+H2O
B.铜与稀硝酸的反应:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
C.向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.过量二氧化硫与氢氧化钠溶液反应:SO2+OH- =HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对如图所示的实验室制取氨气,下列说法正确的是
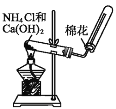
A.发生装置与用 KClO3 制取O2 的装置相同
B.可以用碱石灰或无水氯化钙干燥制得的氨气
C.可用单孔橡皮塞代替棉花
D.所用的铵盐不能是 NH4NO3,所用的碱可以是 NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。AC2是非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子在外界。根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为_________;
(2)B的氢化物的分子立体构型是_____;其中心原子采取_______杂化。
(3)写出化合物AC2的电子式为_______;一种由B、C组成的化合物与AC2互为等电子体,其化学式为______。
(4)E的核外电子排布式是______,ECl3形成的配合物的化学式为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下:![]() 。取适量黄色
。取适量黄色![]() 固体配制成100mL溶液,配制过程中溶液的离子浓度与时间的变化关系如图所示。下列说法中正确的是( )
固体配制成100mL溶液,配制过程中溶液的离子浓度与时间的变化关系如图所示。下列说法中正确的是( )
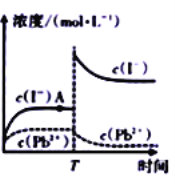
A. A点处可表示![]() 的不饱和溶液
的不饱和溶液
B. T时刻有可能向该![]() 溶液中加人了KI 固体
溶液中加人了KI 固体
C. 常温下![]() 饱和溶液中的
饱和溶液中的![]()
D. 向A点处的![]() 悬浊液中加入
悬浊液中加入![]() 的
的![]() 溶液,平衡后溶液中的c(Pb2+)<4
溶液,平衡后溶液中的c(Pb2+)<4![]() 10-3mol/L
10-3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们祖先的四大发明之一黑火药的爆炸反应为:S+2KNO3+3C![]() A+N2↑+3CO2↑(已配平)。请回答下列问题:
A+N2↑+3CO2↑(已配平)。请回答下列问题:
(1)生成物固体A属于___________晶体,上述化学反应的氧化剂是__________(写化学式);
(2)硫元素在周期表中的位置为_________能说明氯的非金属性比硫强的实验是_______(任写一条即可);
(3)C原子最外层电子的电子排布式是_____,CCl4是一种常见的有机溶剂,写出其电子式_____,判断其属于_________(填“极性”、“非极性”)共价键_____分子(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组,为研究金属的腐蚀和防护的原理,做了以下实验:将剪下的一块镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,按如图所示的装置进行实验,过一段时间后观察,下列现象不可能出现的是( )
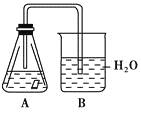
A.B中导气管中产生气泡B.B中导气管里形成一段水柱
C.金属片剪口变红D.锌被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的单质及其化合物性质多样,用途广泛。
完成下列填空。
(1)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2;
2NO+2CO![]() 2CO2+N2+Q(Q>0)
2CO2+N2+Q(Q>0)
某温度下测得该反应在不同时间内的CO浓度如下表:
时间(s) 浓度(mol/L) | 0 | 1 | 2 | 3 | 4 | 5 |
c (CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
该反应的平衡常数表达式为________;温度升高,K值________(选填“增大”、“减小”、“不变”);前2s内的平均反应速率v(N2)=________;若上述反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是_______________。
(2)工业合成氨的反应温度选择500℃左右的原因是_________________。
(3)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是___________。
a.N2、H2、NH3的浓度之比为1∶3∶2
b.容器内的压强保持不变
c. N2、H2、NH3的浓度不再发生变化
d.反应停止,正、逆反应的速率都等于零
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1molNH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度有大到小的顺序是____________;在通入NH3的过程中溶液的导电能力________(选填“变大”、“变小”、“几乎不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联合国宣布2019年为“国际化学元素周期表年”。短周期主族元素A、B、C、D、E的原子序数依次增大。A原子的最外层电子数是其内层电子数的2倍,B的单质是空气的最主要成分,C的单质在某些浓酸溶液中能发生钝化,D和A在同一主族,E的其中一种氧化物是造成酸雨的主要物质之一。请回答下列问题:
(1)A元素的名称为_________;元素E在周期表中的位置是________。
(2)A、B、D的原子半径的大小顺序是_________(用元素符号表示)。A和D的简单气态氢化物中稳定性较强的是___________(用化学式表示)。
(3)B和D最高价氧化物对应的水化物中,酸性较强的是___________。若用如图中装置验证这两种酸的酸性强弱,则在装置Ⅱ中加入的试剂分别为__________,观察到的实验现象是__________。
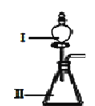
(4)AE2常温下呈液态,则AE2的化学键类型是_______。已知AE2在氧气中完全燃烧,生成AO2和EO2,若 0.1 mol AE2在 1 mol O2中完全燃烧,所得混合气体在标准状况下的体积为________L。
(5)B的最高价氧化物对应的水化物的稀溶液与SO2反应的离子方程式为________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com