
【题目】下列离子方程式中,正确的是( )
A.碳酸氢铵溶液中加入足量的浓氢氧化钠溶液并加热:NH4++OH- =NH3↑+H2O
B.铜与稀硝酸的反应:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
C.向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.过量二氧化硫与氢氧化钠溶液反应:SO2+OH- =HSO3-
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. ![]() 固体含有离子的数目为
固体含有离子的数目为![]()
B. 常温下,![]() 的醋酸溶液中H+数目为
的醋酸溶液中H+数目为![]()
C. 13g由![]() C和
C和![]() 组成的碳单质中所含质子数一定为
组成的碳单质中所含质子数一定为![]()
D. ![]() 与足量
与足量![]() 在一定条件下化合,转移电子数为
在一定条件下化合,转移电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。
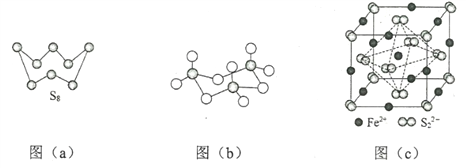
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮(N)、磷(P)、砷(As)等ⅤA元素化合物在研究和生产中有重要用途。如我国科研人员研究发现As2O3或写成As4O6,俗称砒霜)对白血病有明显的治疗作用。回答下列问题:
(1)As原子的简化的核外电子排布式为_____;P的第一电离能比S大的原因为________。
(2)写出一种与CN-互为等电子体的分子___(用化学式表示);(SCN)2分子中σ键和π键个数比为__。
(3)砒霜剧毒,可用石灰消毒生成AsO33-少量AsO43-,其中AsO33-中As的杂化方式为___,AsO43-的空间构型为___。
(4)NH4+中H-N-H键角比NH3中H-N-H的键角大的原因是____;NH3和水分子与铜离子形成的化合物中阳离子呈轴向狭长的八面体结构(如图Ⅰ),该化合物加热时首先失去水,请从原子结构角度加以____。
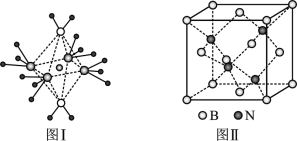
(5)BN的熔点为3000℃,密度为2.25g/cm3,其晶胞结构如上图Ⅱ所示,晶体中一个B原子周围距离最近的N原子有____个;若原子半径分别为rN和rB,阿伏加德罗常数值为NA,则BN晶胞中原子的体积占晶胞体积的百分率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)[化学——选修5:有机化学基础]
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:

已知:![]()
回答下列问题:
(1)A的化学名称是________________。
(2)B为单氯代烃,由B生成C的化学方程式为________________。
(3)由A生成B、G生成H的反应类型分别是________________、________________。
(4)D的结构简式为________________。
(5)Y中含氧官能团的名称为________________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1 L0.1 mol·L-1 氨水中含有0.1NA NH3分子
B.46 g NO2和N2O4混合气体中含有的原子数为3NA
C.1 mol Na2O2中含有的阴离子数为2NA
D.常温常压下,12 g14C所含中子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于放热反应Zn+H2SO4=ZnSO4+H2↑,下列叙述正确的是( )
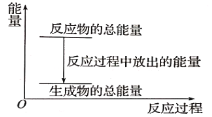
A. 反应过程中的能量关系可用上图表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则其能量转化形式为电能转化为化学能
D. 若将其设计为原电池,当有32.5gZn溶解时,正极放出的气体一定为11.2L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,属于非极性分子
B. 水很稳定是因为水中含有大量的氢键所致
C. H2O、NH3、CH4分子中的O、N、C分别形成2个、3个、4个键,故O、N、C原子分别采取sp、sp2、sp3杂化
D. 配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1mol·L-1 的 FeCl3 溶液呈___________性(填“酸”、“碱”或“中”),原因是___(请用离子方程式表示)。电子工业曾用 30%的 FeCl3溶液腐蚀敷有铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得到 FeCl3 溶液,设计如下实验流程:
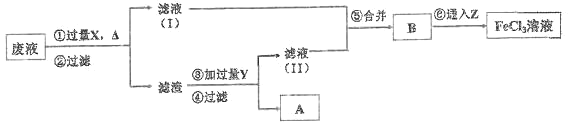
上述流程中,所加试剂的化学式为:X_____,Y_________,Z_____;第⑥步反应的离子方程 式为_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com