
����Ŀ������N�����ף�P�����飨As���Ȣ�AԪ�ػ��������о�������������Ҫ��;�����ҹ�������Ա�о�����As2O3��д��As4O6���׳���˪����Ѫ�������Ե��������á��ش��������⣺
��1��Asԭ�ӵļĺ�������Ų�ʽΪ_____��P�ĵ�һ�����ܱ�S���ԭ��Ϊ________��
��2��д��һ����CN-��Ϊ�ȵ�����ķ���___���û�ѧʽ��ʾ����(SCN)2�����������ͦм�������Ϊ__��
��3����˪�綾������ʯ����������AsO33-����AsO43-������AsO33-��As���ӻ���ʽΪ___��AsO43-�Ŀռ乹��Ϊ___��
��4��NH4+��H-N-H���DZ�NH3��H-N-H�ļ��Ǵ��ԭ����____��NH3��ˮ������ͭ�����γɵĻ������������ӳ����������İ�����ṹ����ͼ���û��������ʱ����ʧȥˮ�����ԭ�ӽṹ�Ƕȼ���____��
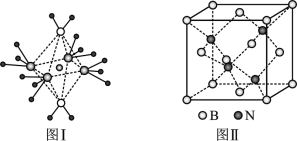
��5��BN���۵�Ϊ3000�棬�ܶ�Ϊ2.25g/cm3���侧���ṹ����ͼ����ʾ��������һ��Bԭ����Χ���������Nԭ����____������ԭ�Ӱ뾶�ֱ�ΪrN��rB�������ӵ�����ֵΪNA����BN������ԭ�ӵ����ռ��������İٷ���Ϊ_____��
���𰸡�1s22s22p63s23p63d104s24p3��[Ar]3d104s24p3 P��p�ܼ��ǰ����״̬���Ƚ��ȶ������Ե�һ�����ܱ���� CO��N2 5:4 sp3 �������� NH4+�ĵ�ԭ���Ͼ�Ϊ�ɼ����ӣ���NH3�����еĵ�ԭ������һ�Թ¶Ե��ӣ��¶Ե�����ɼ�����֮����ų���ǿ�ڳɼ�������ɼ�����֮����ų���������NH4+��H-N-H���DZ�NH3�д� ����Oԭ�Ӱ뾶С���縺�Դ��ṩ�¶Ե���������Nԭ��������ˮ�����γɵ���λ�����ڰ����� 4 ![]() ��100%
��100%
��������
��1��Asԭ�Ӻ�����33�����ӣ����ݹ���ԭ���жϺ�������Ų�������A��Ԫ�������p����ǰ����״̬������������Ԫ�ص�һ�����ܴ�
��2��CN-ԭ����Ϊ2���۵�����Ϊ10���ҵȵ���������������������SCN��2�ĽṹʽΪN![]() C��S��S��C
C��S��S��C![]() N�����ݽṹʽ������������������
N�����ݽṹʽ������������������
��3���ȼ���AsO33-��As�ϵŵ��Ӷ������ɼ����Ӷ����������ԭ������As�ļ۲���Ӷ���=�µ��Ӷ���+�ɼ����Ӷ�����Ȼ������ӻ���ʽ�Ϳռ乹�ͣ�
��4���¶Ե�����ɼ�����֮����ų���ǿ�ڳɼ�������ɼ�����֮����ų��������ǵ��¼��Ǵ�С��ԭ����ʱ����ʧȥˮ��˵��ˮ������Cu2+�γɵ���λ������NH3������Ȼ�����ˮ�����γɵ���λ�����ڰ�����ԭ�ɣ�
��5�����ݾ���ͼ�ж�һ��Nԭ����Χ���������Bԭ���ж��ٸ���������̯������Bԭ�Ӹ�����Nԭ�Ӹ�����Ȼ�����������ԭ�ӵ����ռ��������İٷֱȾ��ǿռ������ʡ�
��1��Asԭ�Ӻ�����33�����ӣ����ݹ���ԭ����Asԭ�ӵĺ�������Ų�ʽΪ1s22s22p63s23p63d104s24p3��[Ar] 3d104s24p3��P��S�����ڵ������ڣ�S�ļ۵����Ų�ʽΪ3s23p4��P�ļ۵����Ų�ʽΪ3s23p3��P��3p�ܼ����ڰ�������Ƚ��ȶ���P�ĵ�һ�����ܱ�S�Ĵ𰸣�1s22s22p63s23p63d104s24p3��[Ar]3d104s24p3��P��p�ܼ��ǰ����״̬���Ƚ��ȶ������Ե�һ�����ܱ����
��2�����������������CN-��Ϊ�ȵ������������CO��N2��C22-�ȣ���SCN��2�ĽṹʽΪN![]() C��S��S��C
C��S��S��C![]() N������ȫ����������������1��������2����������SCN��2��������5��������4������������������������Ϊ5:4���𰸣�CO��N2��5:4��
N������ȫ����������������1��������2����������SCN��2��������5��������4������������������������Ϊ5:4���𰸣�CO��N2��5:4��
��3��AsO33-��As�ϵŵ��Ӷ���=![]() ��5+3-3
��5+3-3![]() 2��=1���ɼ����Ӷ���Ϊ3��As�ļ۲���Ӷ���Ϊ1+3=4��As���ӻ���ʽΪsp3�ӻ���AsO43-��As�ϵŵ��Ӷ���=
2��=1���ɼ����Ӷ���Ϊ3��As�ļ۲���Ӷ���Ϊ1+3=4��As���ӻ���ʽΪsp3�ӻ���AsO43-��As�ϵŵ��Ӷ���=![]() ��5+3-4
��5+3-4![]() 2��=0���ɼ����Ӷ���Ϊ4��As�ļ۲���Ӷ���Ϊ0+4=4��AsO43-��VSEPRģ��Ϊ�������壬����û�йµ��Ӷԣ�AsO43-�Ŀռ乹��Ϊ�������壻�𰸣� sp3���������壻
2��=0���ɼ����Ӷ���Ϊ4��As�ļ۲���Ӷ���Ϊ0+4=4��AsO43-��VSEPRģ��Ϊ�������壬����û�йµ��Ӷԣ�AsO43-�Ŀռ乹��Ϊ�������壻�𰸣� sp3���������壻
��4��NH4+��H��N��H�ļ��DZ�NH3��H��N��H
��5��������̯������B��8![]() +6
+6![]() =4��N��4���þ���Ļ�ѧʽΪBN�����ݾ�����������һ��Nԭ����Χ���������Bԭ����4������һ��Bԭ����Χ���������Nԭ����4����һ��������ԭ�ӵ����Ϊ4
=4��N��4���þ���Ļ�ѧʽΪBN�����ݾ�����������һ��Nԭ����Χ���������Bԭ����4������һ��Bԭ����Χ���������Nԭ����4����һ��������ԭ�ӵ����Ϊ4![]() ��
��![]() ��rN3+
��rN3+![]() ��rB3��pm3=4
��rB3��pm3=4![]() ��
��![]() ��rN3+
��rN3+![]() ��rB3��
��rB3��![]() 10-30cm3��1mol���������Ϊ25g��1mol��������Ϊ25g
10-30cm3��1mol���������Ϊ25g��1mol��������Ϊ25g![]() 2.25g/cm3�����������Ϊ4
2.25g/cm3�����������Ϊ4![]() ��25g
��25g![]() 2.25g/cm3
2.25g/cm3![]() NA����BN������ԭ�ӵ����ռ��������İٷ���Ϊ4
NA����BN������ԭ�ӵ����ռ��������İٷ���Ϊ4![]() ��
��![]() ��rN3+
��rN3+![]() ��rB3��
��rB3��![]() 10-30cm3
10-30cm3![]() [4
[4![]() ��25g
��25g![]() 2.25g/cm3
2.25g/cm3![]() NA��]=
NA��]=![]() ��100%���𰸣�
��100%���𰸣�![]() ��100%��
��100%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ��ʾ���Ӧ�����������
A. 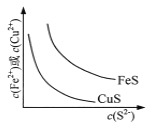 ��ʾһ���¶���FeS��CuS�ij����ܽ�ƽ�����ߣ���Ksp(FeS) <Ksp(CuS)
��ʾһ���¶���FeS��CuS�ij����ܽ�ƽ�����ߣ���Ksp(FeS) <Ksp(CuS)
B. 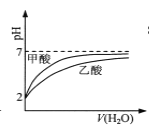 pH=2�ļ�����������Һϡ��ʱ��pH�仯���ߣ������ԣ�����<����
pH=2�ļ�����������Һϡ��ʱ��pH�仯���ߣ������ԣ�����<����
C. 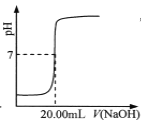 ��ʾ��0.1000 mol��L-lNaOH��Һ�ζ�25.00 mL����ĵζ����ߣ��� c(HCl)=0.0800 mol ��L-1
��ʾ��0.1000 mol��L-lNaOH��Һ�ζ�25.00 mL����ĵζ����ߣ��� c(HCl)=0.0800 mol ��L-1
D. 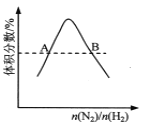 ��ӦN2(g)+3H2(g)
��ӦN2(g)+3H2(g) ![]() 2NH3(g)ƽ��ʱNH3�����������ʼn(N2)/n(H2)�仯�����ߣ���ת���ʣ���A(H2)=��B(H2)
2NH3(g)ƽ��ʱNH3�����������ʼn(N2)/n(H2)�仯�����ߣ���ת���ʣ���A(H2)=��B(H2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й��Ŵ��Ĵ���֮һ�ڻ�ҩ�����ı�ը��ӦΪ��S +2KNO3+3C �� A+N2��+3CO2��������ƽ��
��1����S�⣬����Ԫ�صĵ縺�Դ�С��������Ϊ_______����K��S���һ�����ܴӴ�С��˳��Ϊ______________��
��2�����������У�AΪ______�����CO2Ϊ_______������������ӻ��������ۻ�����������Թ��ۼ��ķ��ӵ�����ԭ�ӹ���ӻ�����Ϊ______________��
��3��CN����N2��Ϊ______��д��CN���ĵ���ʽ________������HCN������������������Ŀ֮��_________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ï������[Fe (C5H5)2]��һ�ֽ����л�������ȼ���͵����Ӽ����������ȼ�յ�Ч�ʺ�ȥ�̣�����Ϊ���������ǵ�Ϳ�ϵȡ����Ľṹ��ͼ��ʾ������˵����ȷ���ǣ� ��
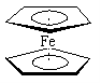
A����ï����Fe2+�뻷���ϩ���ӣ�C5H5-��֮��Ϊ���Ӽ�
B��1mol�����ϩ��![]() ���к�����������ĿΪ5NA
���к�����������ĿΪ5NA
C����ï�������д�������
D��Fe2���ĵ����Ų�ʽΪ1s22s22p63s23p63d44s2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ե��ۻ���ϩΪ��Ҫԭ�϶����Ժϳ�������������ϳ�·����ͼ��ʾ��

����֪��2CH3CHO+O2![]() 2CH3COOH��
2CH3COOH��
��1��A�к��еĹ�����������______________�����Т۵ķ�Ӧ������______________��
�ķ�Ӧ������______________��
��2��д��ϩ�ĵ���ʽ��_________________��ϩ�Ľṹ��ʽ��____________;
��3��д�����з�Ӧ�Ļ�ѧ����ʽ����__________________;��______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��K3[Fe(C2O4)3]��3H2O�������������أ�Ϊ����ɫ���壬������ɹ����ͼ���ش��������⣺
��1��ɹ����ͼʱ����K3[Fe(C2O4)3]��3H2O���й������K3[Fe(CN)6]��ҺΪ��ɫ�������ⷴӦ�Ļ�ѧ����ʽΪ��2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2������ɫ��Ӧ�Ļ�ѧ����ʽΪ______________��
2FeC2O4+3K2C2O4+2CO2������ɫ��Ӧ�Ļ�ѧ����ʽΪ______________��
��2��ijС��Ϊ̽�������������ص��ȷֽ�������ͼ��ʾװ�ý���ʵ�顣
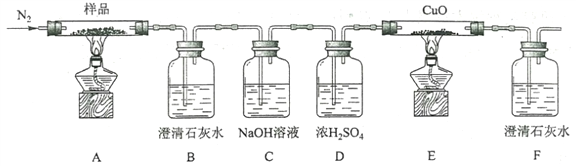
��ͨ�뵪����Ŀ����________________________________________��
��ʵ���й۲쵽װ��B��F�г���ʯ��ˮ������ǣ�װ��E�й����Ϊ��ɫ���ɴ��ж��ȷֽ������һ������___________��___________��
��Ϊ��ֹ������ֹͣʵ��ʱӦ���еIJ�����_____________________________��
����Ʒ��ȫ�ֽ��װ��A�еIJ����ﺬ��FeO��Fe2O3������Fe2O3���ڵķ����ǣ�________________��
��3���ⶨ�����������������ĺ�����
�ٳ���m g��Ʒ����ƿ�У��ܽ���ϡH2SO4�ữ����c mol��L-1 KMnO4��Һ�ζ����յ㡣�ζ��յ��������___________________________��
����������Һ�м������п������Ӧ��ȫ���ˡ�ϴ�ӣ�����Һ��ϴ��Һȫ���ռ�����ƿ�С���ϡH2SO4�ữ����c mol��L-1 KMnO4��Һ�ζ����յ㣬����KMnO4��ҺV mL���þ������������������ı���ʽΪ________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ�У���ȷ����( )
A.̼�������Һ�м���������Ũ����������Һ�����ȣ�NH4++OH- =NH3��+H2O
B.ͭ��ϡ����ķ�Ӧ��Cu+4H++2NO3-=Cu2++2NO2��+2H2O
C.��Ba(OH)2��Һ�еμ�ϡ���Ba2++OH-+H++SO42-=BaSO4��+H2O
D.������������������������Һ��Ӧ��SO2+OH- =HSO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ϩ��ױ�Ϊ��Ҫԭ�ϣ�������·�߿ɺϳ��л���E��F��

��֪��![]()
��ش�
(1)B�й����ŵ�������_________,��Ӧ�ķ�Ӧ������__________��
(2)F�Ľṹ��ʽ___________________________��
(3)D��E�Ļ�ѧ����ʽ_________________________________��
(4)�����й�˵������ȷ����_________��
A.E�������Ƶ�Cu(OH)2����Һ������Ӧ����B���������Ƶ�Cu(OH)2����Һ������Ӧ
B��![]() ����ʹ����KMnO4��Һ��ɫ
����ʹ����KMnO4��Һ��ɫ
C��1molE������H2��Ӧ���������4molH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E�������ڱ���ǰ�����ڵ�Ԫ�أ����ǵĺ˵����A<B<C<D<E������A��B��C��ͬһ���ڵķǽ���Ԫ�ء�AC2�ǷǼ��Է��ӡ�B��C���⻯��ķе������ͬ����������Ԫ���⻯��ķе�ߡ�E��ԭ������Ϊ24��ECl3����B��C���⻯���γ�����λ��������������������ʵ���֮��Ϊ2:1����������������硣��������������ش��������⣺(����ʱ��A��B��C��D��E������Ӧ��Ԫ�ط��ű�ʾ)
(1)A��B��C�ĵ�һ��������С�����˳��Ϊ_________��
(2)B���⻯��ķ������幹����_____��������ԭ�Ӳ�ȡ_______�ӻ���
(3)д��������AC2�ĵ���ʽΪ_______��һ����B��C��ɵĻ�������AC2��Ϊ�ȵ����壬�仯ѧʽΪ______��
(4)E�ĺ�������Ų�ʽ��______��ECl3�γɵ������Ļ�ѧʽΪ_____
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com