
【题目】图所示与对应叙述相符的是
A. 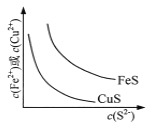 表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS) <Ksp(CuS)
表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS) <Ksp(CuS)
B. 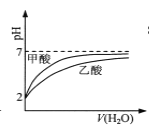 pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 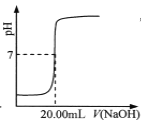 表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 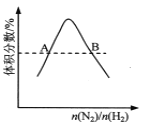 反应N2(g)+3H2(g)
反应N2(g)+3H2(g) ![]() 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
【答案】C
【解析】
A.当相同c(S2-)时,由图像可知,平衡时c(Cu2+)<c(Fe2+),则c(Fe2+)c(S2-)>c(Cu2+)c(S2-),根据Ksp(FeS)=c(Fe2+)c(S2),Ksp(CuS)=c(Cu2+)c(S2),则Ksp(FeS)>Ksp(CuS),故A错误;
B.溶液中pH值与c(H+)间的关系为pH=-lgc(H+),溶液中c(H+)大,对应的pH值就小,当稀释弱酸时,随着水的加入,稀释可以促进弱酸的电离,但是总体来讲,溶液体积的增量超过溶液中H+的物质的量的增量,表现为溶液中c(H+)=![]() 减小,pH值增大;由于稀释促进弱酸的电离,因而在稀释相同倍数的弱酸时,对于酸性较弱的酸,能够促进其电离,增加了溶液中H+的量,也就表现为c(H+)会较酸性较强的弱酸大些,pH就较酸性较强的弱酸小些,因此总的来讲,酸性较强的弱酸稀释后对应的溶液pH值越大,从图像看出,甲酸的酸性是较乙酸强,即酸性甲酸>乙酸,故B错误;
减小,pH值增大;由于稀释促进弱酸的电离,因而在稀释相同倍数的弱酸时,对于酸性较弱的酸,能够促进其电离,增加了溶液中H+的量,也就表现为c(H+)会较酸性较强的弱酸大些,pH就较酸性较强的弱酸小些,因此总的来讲,酸性较强的弱酸稀释后对应的溶液pH值越大,从图像看出,甲酸的酸性是较乙酸强,即酸性甲酸>乙酸,故B错误;
C.用0.1000mol/L的NaOH溶液滴定25.00mL的盐酸溶液,由图像可知,当消耗NaOH体积为20.00mL时,溶液为中性,此时酸和碱恰好完全反应,溶液中c(H+)=c(OH-),即n(H+)=n(OH-),则有c(HCl)V(HCl)=c(NaOH)V(NaOH),因此c(HCl)=![]() =
=![]() =0.0800mol/L,故C正确;
=0.0800mol/L,故C正确;
D.由图像可知,A与B状态时NH3的百分含量相等,对于有两种反应物参加的可逆反应,增加其中一种反应物的物料可使另一种反应物的转化率增加;A状态时,![]() 值较小,可认为是增加了H2的量使得H2自身的转化率变小,B状态时,
值较小,可认为是增加了H2的量使得H2自身的转化率变小,B状态时,![]() 值较大,可认为是增加了N2的量,从而提高了H2的转化率,转化率αA(H2)不一定等于αB(H2),故D错误;
值较大,可认为是增加了N2的量,从而提高了H2的转化率,转化率αA(H2)不一定等于αB(H2),故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

A. 图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B. 图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C. 图丙表示催化剂能改变化学反应的焓变
D. 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)![]() N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.将5.85 g NaCl晶体溶入100 mL水中,制得1 mol·L-1NaCl溶液
B.将1体积c mol·L-1硫酸加入水中稀释为5体积,得到0.2c mol·L-1硫酸
C.将25 g无水CuSO4溶于水配制成100 mL溶液,其浓度为1 mol·L-1
D.用浓盐酸配制一定物质的量浓度的稀盐酸,量取浓盐酸时仰视量筒的刻度线会导致所配溶液浓度偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2,其反应过程可表示为:
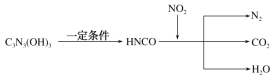
下列说法正确的是( )
A.反应中NO2是还原剂
B.C3N3(OH)3与HNCO为同一物质
C.HNCO与NO2反应的化学计量数之比为3:4
D.反应过程中,每1 mol NO2参加反应,转移电子4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,纵坐标表示电导率,横坐标表示所加溶液的量,以下各组反应符合该图的是(不考虑溶液混合体积的变化)( )
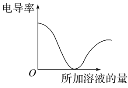
A.向Ba(OH)2溶液中滴加稀H2SO4
B.向NaOH溶液中滴加稀HCl
C.向纯水中加入NaCl溶液
D.向KCl溶液中滴加NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向二元弱酸H2Y溶液中滴加KOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示。下列有关说法错误的是( )
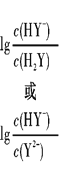
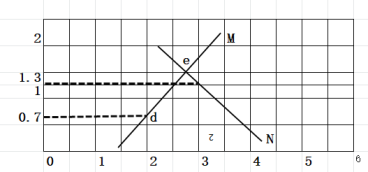
A. 曲线M表示pH与lg[c(HY-)/c(H2Y)]的变化关系
B. 交点e的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)
C. d点溶液中:c(H+)-c(OH-)=2c(Y2-)+c(HY-)-c(K+)
D. Ka2(H2Y)=10-4.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. ![]() 固体含有离子的数目为
固体含有离子的数目为![]()
B. 常温下,![]() 的醋酸溶液中H+数目为
的醋酸溶液中H+数目为![]()
C. 13g由![]() C和
C和![]() 组成的碳单质中所含质子数一定为
组成的碳单质中所含质子数一定为![]()
D. ![]() 与足量
与足量![]() 在一定条件下化合,转移电子数为
在一定条件下化合,转移电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学健断裂时吸收的能量与化学健形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是

A. 1molN2(g)和1molO2(g)反应放出的能量为180kJ
B. 1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
C. 在1L的容器中发生反应.10min内N2减少了1mol,因此10min内的平均反应速率为v(NO)=0.1mol/(L·min)
D. NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮(N)、磷(P)、砷(As)等ⅤA元素化合物在研究和生产中有重要用途。如我国科研人员研究发现As2O3或写成As4O6,俗称砒霜)对白血病有明显的治疗作用。回答下列问题:
(1)As原子的简化的核外电子排布式为_____;P的第一电离能比S大的原因为________。
(2)写出一种与CN-互为等电子体的分子___(用化学式表示);(SCN)2分子中σ键和π键个数比为__。
(3)砒霜剧毒,可用石灰消毒生成AsO33-少量AsO43-,其中AsO33-中As的杂化方式为___,AsO43-的空间构型为___。
(4)NH4+中H-N-H键角比NH3中H-N-H的键角大的原因是____;NH3和水分子与铜离子形成的化合物中阳离子呈轴向狭长的八面体结构(如图Ⅰ),该化合物加热时首先失去水,请从原子结构角度加以____。
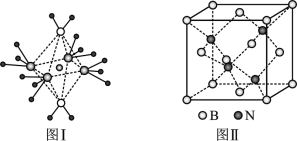
(5)BN的熔点为3000℃,密度为2.25g/cm3,其晶胞结构如上图Ⅱ所示,晶体中一个B原子周围距离最近的N原子有____个;若原子半径分别为rN和rB,阿伏加德罗常数值为NA,则BN晶胞中原子的体积占晶胞体积的百分率为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com