
【题目】三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2,其反应过程可表示为:
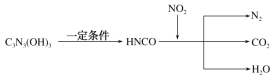
下列说法正确的是( )
A.反应中NO2是还原剂
B.C3N3(OH)3与HNCO为同一物质
C.HNCO与NO2反应的化学计量数之比为3:4
D.反应过程中,每1 mol NO2参加反应,转移电子4 mol
【答案】D
【解析】
A.根据图示,NO2在反应中N元素由+4价降低到0价,则NO2是氧化剂,故A错误;
B.由C3N3(OH)3 ![]() 3HNCO可知,C3N3(OH)3与HNCO的化学式不同,C3N3(OH)3与HNCO为不同物质,故B错误;
3HNCO可知,C3N3(OH)3与HNCO的化学式不同,C3N3(OH)3与HNCO为不同物质,故B错误;
C.反应中氧化剂是NO2,还原剂是HNCO,8HNCO+6NO2 ![]() 7N2+8CO2+4H2O,由化学计量数可知还原剂HNCO、氧化剂NO2的物质的量之比为4∶3,故C错误;
7N2+8CO2+4H2O,由化学计量数可知还原剂HNCO、氧化剂NO2的物质的量之比为4∶3,故C错误;
D.反应的方程式为8HNCO+6NO2 ![]() 7N2+8CO2+4H2O,HNCO中N元素由-3升高到0,NO2中N元素由+4降低到0,6molNO2在反应中转移的电子为24mol,则1molNO2在反应中转移的电子为4mol,故D正确;
7N2+8CO2+4H2O,HNCO中N元素由-3升高到0,NO2中N元素由+4降低到0,6molNO2在反应中转移的电子为24mol,则1molNO2在反应中转移的电子为4mol,故D正确;
故选D。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】(1)一定温度下,在恒容密闭容器中NO2与O2反应为4NO2(g)+O2(g)![]() 2N2O5(g)。(不考虑NO2的分解 ) 若已知该反应是放热反应,则K550℃___K350℃,(填“大于” “等于”或“小于”)。反应达平衡后,若再通入一定量NO2,则平衡常数K将_______,NO2的转化率______。(填“增大”“减小”或“不变”)
2N2O5(g)。(不考虑NO2的分解 ) 若已知该反应是放热反应,则K550℃___K350℃,(填“大于” “等于”或“小于”)。反应达平衡后,若再通入一定量NO2,则平衡常数K将_______,NO2的转化率______。(填“增大”“减小”或“不变”)
(2)若初始时在恒容密闭容器中加入N2O5,下表为N2O5分解反应在一定温度下不同时间测得N2O5浓度的部分实验数据:
t/s | 0 | 500 | 1000 |
c(N2O5) mol/L | 5.00 | 3.25 | 2.48 |
①写出该反应的平衡常数表达式:K=____________。
②1000s内N2O5的分解速率为:_____________。
③若每有1 mol N2O5分解,吸收Q kJ的热量,写出该分解反应的热化学方程式____。
④能使4NO2(g)+O2(g)![]() 2N2O5(g)反应速率增大,且平衡向正反应方向移动的是(_______)
2N2O5(g)反应速率增大,且平衡向正反应方向移动的是(_______)
a.及时分离出N2O5 b.适当提高温度 c.增大O2浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在________下能够导电的化合物叫做电解质。电解质溶液之所以能够导电,是由于它们在溶液中发生了_______,产生了__________。电离时生成的_____离子全部是___的化合物叫做酸;生成的______离子全部是_____的化合物叫做碱。酸碱发生中和反应的实质是_____。(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法正确的是( )
A.常温下,1 mol Fe投入足量浓硫酸,转移电子数为3NA
B.5NH4NO3=2HNO3+4N2↑+9H2O,生成28 g N2时,转移的电子数目为3.75NA
C.1 mol Na2O2与足量CO2充分反应转移的电子数目为2NA
D.1molAl与足量氢氧化钠溶液反应,NaOH得电子数为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,物质①4 g H2,② 33.6L CH4,③1mol H2O ,④3.01×1023个O2.(填序号,下同)
(1)质量最大的是________________,(2)分子数最多的是_____________,
(3)原子数最少的是______________,(4)体积最小的是________________.
(5)电子数最多的是_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种中学常见的物质转化如图所示。
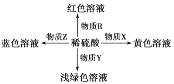
下表中R、X、Y、Z对应物质正确的是( )
选项 | R | X | Y | Z |
A | 紫色石蕊 | Fe2O3 | Fe2O3和Cu | Cu |
B | 甲基橙 | Fe(NO3)2 | Fe(OH)2 | Cu2(OH)2CO3 |
C | 酚酞 | Fe(OH)3 | FeO和Fe | CuO |
D | Fe2O3 | Na[Al(OH)4] | Na2SiO3 | Cu(OH)2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图所示与对应叙述相符的是
A. 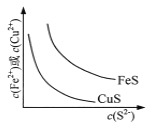 表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS) <Ksp(CuS)
表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS) <Ksp(CuS)
B. 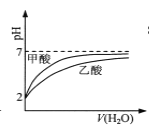 pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 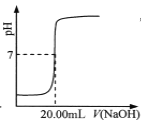 表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 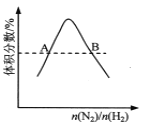 反应N2(g)+3H2(g)
反应N2(g)+3H2(g) ![]() 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)及其化合物在工业上有许多用途。以辉锑矿(主要成分为Sb2S3,还含有PbS、As2S3、CuO、SiO2等)为原料制备金属锑的工艺流程如图所示:

已知:① 浸出液中除含过量盐酸和SbCl5之外,还含有SbCl3、PbCl2、AsCl3、CuCl2等;
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度小于等于1.0×10-5mol·L-1时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有___________(填化学式)。
(2)“浸出”时,Sb2S3发生反应的化学方程式为_________________。
(3)“还原”时,被Sb还原的物质为_____________(填化学式)。
(4)常温下,“除铜、铅”时,Cu2+和Pb2+均沉淀完全,此时溶液中的c(S2-)不低于______;所加Na2S也不宜过多,其原因为_____________。
(5)“除砷”时有H3PO3生成,该反应的离子方程式为________________。
(6)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁分子[Fe (C5H5)2]是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法正确的是( )
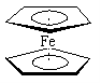
A.二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为离子键
B.1mol环戊二烯(![]() )中含有σ键的数目为5NA
)中含有σ键的数目为5NA
C.二茂铁分子中存在π键
D.Fe2+的电子排布式为1s22s22p63s23p63d44s2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com