
【题目】下列叙述正确的是( )
A.将5.85 g NaCl晶体溶入100 mL水中,制得1 mol·L-1NaCl溶液
B.将1体积c mol·L-1硫酸加入水中稀释为5体积,得到0.2c mol·L-1硫酸
C.将25 g无水CuSO4溶于水配制成100 mL溶液,其浓度为1 mol·L-1
D.用浓盐酸配制一定物质的量浓度的稀盐酸,量取浓盐酸时仰视量筒的刻度线会导致所配溶液浓度偏低
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子。该厂拟定如图所示的废水处理流程。

回答以下问题:
(1)上述处理废水的流程中主要使用的方法是__________________
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因________________。
(3)②中反应后无气体放出,该反应的离子方程式为___________________。
(4)③中反应时,每0.4mol Cr2O72-转移2.4mol的电子,该反应的离子方程式为______________。
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少,请你使用化学用语,结合必要的文字解释其原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子纳米活性钛无霸是钛氧化物经过光照射,在其表面产生氧化性极强的活性离子,这种活性离子可以分解存在生活空间中的一些有害物质(甲醛、氮氧化物等)。
(1)Ti2+的基态价电子排布式为_______________________。
(2)甲醛分子中C原子轨道杂化类型为____________。1mol甲醛分子中含有σ键的数目为___________。
(3)甲醛易溶于水,除因为它们都是极性分子外,还因为_______________________。
(4)与N2O互为等电子体的一种分子为________________________(填化学式) 。
(5)某含钛化合物晶胞结构如图所示,该化合物的化学式为_____________________。
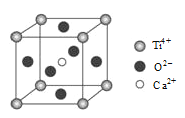
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在________下能够导电的化合物叫做电解质。电解质溶液之所以能够导电,是由于它们在溶液中发生了_______,产生了__________。电离时生成的_____离子全部是___的化合物叫做酸;生成的______离子全部是_____的化合物叫做碱。酸碱发生中和反应的实质是_____。(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图用交叉分类法表示了一些概念之间的关系,其中不正确的是( )
X | Y | Z |
| |
A | 硫酸铜 | 盐 | 纯净物 | |
B | 碱性氧化物 | 金属氧化物 | 氧化物 | |
C | 酸性氧化物 | 非金属氧化物 | 氧化物 | |
D | 强电解质 | 电解质 | 化合物 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法正确的是( )
A.常温下,1 mol Fe投入足量浓硫酸,转移电子数为3NA
B.5NH4NO3=2HNO3+4N2↑+9H2O,生成28 g N2时,转移的电子数目为3.75NA
C.1 mol Na2O2与足量CO2充分反应转移的电子数目为2NA
D.1molAl与足量氢氧化钠溶液反应,NaOH得电子数为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,物质①4 g H2,② 33.6L CH4,③1mol H2O ,④3.01×1023个O2.(填序号,下同)
(1)质量最大的是________________,(2)分子数最多的是_____________,
(3)原子数最少的是______________,(4)体积最小的是________________.
(5)电子数最多的是_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图所示与对应叙述相符的是
A. 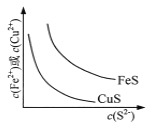 表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS) <Ksp(CuS)
表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS) <Ksp(CuS)
B. 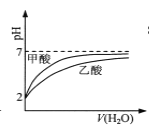 pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 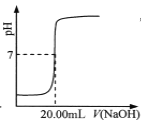 表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 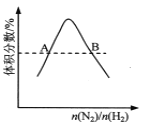 反应N2(g)+3H2(g)
反应N2(g)+3H2(g) ![]() 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代四大发明之一黑火药,它的爆炸反应为:S +2KNO3+3C ﹦ A+N2↑+3CO2↑(已配平)
(1)除S外,上述元素的电负性从小到大依次为_______。除K、S外第一电离能从大到小的顺序为______________。
(2)在生成物中,A为______化合物,CO2为_______化合物(填“离子化合物”或共价化合物),含极性共价键的分子的中心原子轨道杂化类型为______________。
(3)CN﹣与N2互为______,写出CN﹣的电子式________。推算HCN分子中σ键与π键数目之比_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com