
【题目】如图用交叉分类法表示了一些概念之间的关系,其中不正确的是( )
X | Y | Z |
| |
A | 硫酸铜 | 盐 | 纯净物 | |
B | 碱性氧化物 | 金属氧化物 | 氧化物 | |
C | 酸性氧化物 | 非金属氧化物 | 氧化物 | |
D | 强电解质 | 电解质 | 化合物 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H= -49.0kJ·mol-1。一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示,下列叙述中正确的是
CH3OH(g)+H2O(g) △H= -49.0kJ·mol-1。一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示,下列叙述中正确的是

A.欲增大平衡状态时c(CH3OH)/c(CO2)的比值, 可采用 升高温度的方法
B.3min时,CO2的消耗速率等于CH3OH的生成速率,且二者浓度相同
C.欲提高H2的平衡转化率只能减小反应容器的体积
D.从反应开始到平衡,CO2的平均反应速率v(CO2)=0.025mol·L﹣1·min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中发生反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。达到平衡时,下列说法正确的是
2SO3(g) ΔH<0。达到平衡时,下列说法正确的是
容器 | 温度/℃ | 物质的起始浓度/mol·L-1 | 物质的平衡浓度/mol·L-1 | ||
c(SO2) | c(O2) | c(SO3) | c(SO3) | ||
Ⅰ | 758 | 0.2 | 0.1 | 0 | 0.044 |
Ⅱ | 758 | 0.1 | 0.05 | 0 | |
Ⅲ | 858 | 0.2 | 0.1 | 0 | |
A. 从开始至平衡时,容器Ⅰ中SO3的反应速率为0.044 mol·L-1·s-1
B. 平衡时,容器Ⅱ中SO3的浓度小于0.022mol·L-1
C. 平衡时,容器Ⅲ中SO3的浓度大于0.044mol·L-1
D. 若起始时,向容器Ⅰ中充入0.02mol SO2、0.01mol O2和0.02mol SO3,则反应向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠及它们的化合物在生产、生活中有着重要的用途。
Ⅰ.碳酸氢钠可做安全气囊中的冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式是___。
Ⅱ.高压钠灯发光效率高、穿透力强、耗电少,寿命长。这种灯发出的光为___色。
Ⅲ.过氧化钠是重要的工业漂白剂。某课外活动小组设计了下列装置,验证二氧化碳跟过氧化钠反应时需要与水接触。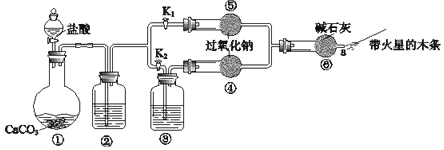
(1)(装置分析)
①装置①中反应的离子方程式是___。
②装置②中的试剂是___(填序号)。
a.饱和NaHCO3溶液 b.饱和Na2CO3溶液 c.浓H2SO4
③装置③中的试剂是___。
(2)(进行实验)
步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
①步骤1和步骤2中,a处带火星的木条产生的实验现象分别是___。
②过氧化钠跟二氧化碳反应的化学方程式是__。
(3)(实验反思)
①有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应。”其理由是__。
②需要补充的实验操作是:取⑤中反应后的少量固体,___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下.有浓度均为0.1 mol·L-l的下列4种溶液:①NaCN溶液②NaOH溶液③CH3COONa溶液④Na2CO3溶液
HCN | H2CO3 | CH3COOH |
Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)这4种溶液pH由大到小的顺序是_______(填序号)。
(2)NaCN溶液显碱性的原因(用方程式说明)______
(3)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③_____④(填“>”、“<"、“=”)。
(4)25℃时,将amol·L-1 的醋酸和 0.1 mol·L-lNaOH溶液等体积混合后,溶液的pH=7,则a_____0.1(填“﹥”、“﹤”或“=”)。
(5)Na2CO3溶液中离子浓度大小为:___________
(6)向NaCN溶液中通入CH3COOH,则发生的离子反应方程式为:_______。
(7)同温下,溶液的pH值④____①(填“>”、“<"、“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.将5.85 g NaCl晶体溶入100 mL水中,制得1 mol·L-1NaCl溶液
B.将1体积c mol·L-1硫酸加入水中稀释为5体积,得到0.2c mol·L-1硫酸
C.将25 g无水CuSO4溶于水配制成100 mL溶液,其浓度为1 mol·L-1
D.用浓盐酸配制一定物质的量浓度的稀盐酸,量取浓盐酸时仰视量筒的刻度线会导致所配溶液浓度偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能说明元素的金属性或非金属性相对强弱的是
序号 | 事实 | 推论 |
A | 与冷水反应,Na比Mg剧烈 | 金属性:Na > Mg |
B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca > Mg |
C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S > C |
D | t℃时,Br2+H2 I2+H2 | 非金属性:Br > I |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,纵坐标表示电导率,横坐标表示所加溶液的量,以下各组反应符合该图的是(不考虑溶液混合体积的变化)( )
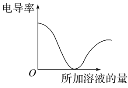
A.向Ba(OH)2溶液中滴加稀H2SO4
B.向NaOH溶液中滴加稀HCl
C.向纯水中加入NaCl溶液
D.向KCl溶液中滴加NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关化学反应速率和限度的图像和实验结论表达均正确的是( )
A.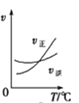 A(g)+3B(g)2C(g),如图是其他条件一定时反应速率随温度变化的图像,图像表明,较低温度下升温平衡逆向移动,较高温度下升温平衡正向移动
A(g)+3B(g)2C(g),如图是其他条件一定时反应速率随温度变化的图像,图像表明,较低温度下升温平衡逆向移动,较高温度下升温平衡正向移动
B.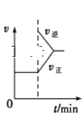 FeCl3+3KSCNFe(SCN)3+3KCl,如图是在平衡体系的溶液中加入少量KCl晶体后化学反应速率随时间的变化
FeCl3+3KSCNFe(SCN)3+3KCl,如图是在平衡体系的溶液中加入少量KCl晶体后化学反应速率随时间的变化
C.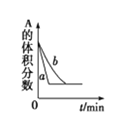 A(g)+3B(g)2C(g),如图可能是催化剂对化学平衡的影响,也可能是其它因素对化学平衡的影响
A(g)+3B(g)2C(g),如图可能是催化剂对化学平衡的影响,也可能是其它因素对化学平衡的影响
D.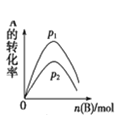 A(g)+3B(g)2C(g),如图是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
A(g)+3B(g)2C(g),如图是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com