
【题目】钠及它们的化合物在生产、生活中有着重要的用途。
Ⅰ.碳酸氢钠可做安全气囊中的冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式是___。
Ⅱ.高压钠灯发光效率高、穿透力强、耗电少,寿命长。这种灯发出的光为___色。
Ⅲ.过氧化钠是重要的工业漂白剂。某课外活动小组设计了下列装置,验证二氧化碳跟过氧化钠反应时需要与水接触。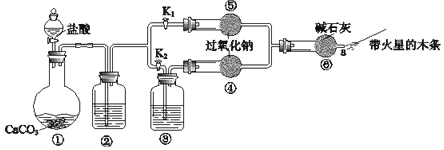
(1)(装置分析)
①装置①中反应的离子方程式是___。
②装置②中的试剂是___(填序号)。
a.饱和NaHCO3溶液 b.饱和Na2CO3溶液 c.浓H2SO4
③装置③中的试剂是___。
(2)(进行实验)
步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
①步骤1和步骤2中,a处带火星的木条产生的实验现象分别是___。
②过氧化钠跟二氧化碳反应的化学方程式是__。
(3)(实验反思)
①有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应。”其理由是__。
②需要补充的实验操作是:取⑤中反应后的少量固体,___。
【答案】2NaHCO3![]() Na2CO3+H2O+CO2↑ 黄色 CaCO3+2H+=Ca2++H2O+CO2↑ a 浓硫酸 步骤1中木条不复燃,步骤2中木条复燃 2Na2O2+2CO2=2Na2CO3+O2 气体中有水,水也可与Na2O2反应产生O2使木条复燃 加入稀盐酸,将产生的气体通入澄清的石灰水中
Na2CO3+H2O+CO2↑ 黄色 CaCO3+2H+=Ca2++H2O+CO2↑ a 浓硫酸 步骤1中木条不复燃,步骤2中木条复燃 2Na2O2+2CO2=2Na2CO3+O2 气体中有水,水也可与Na2O2反应产生O2使木条复燃 加入稀盐酸,将产生的气体通入澄清的石灰水中
【解析】
Ⅰ.碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;
Ⅱ.钠的焰色为黄色;
Ⅲ.(1)①碳酸钙和盐酸反应生成氯化钙、水和二氧化碳;
②碳酸钙和盐酸反应的过程中会混有挥发出的HCl;
③装置③中盛放浓硫酸,用于干燥得到的CO2;
(2)①打开弹簧夹K2,关闭K1,生成少量氧气;打开弹簧夹K1,关闭K2,生成了较多的氧气;
②过氧化钠跟二氧化碳反应,生成碳酸钠和氧气;
(3)①CO2和H2O均可与过氧化钠反应;
②若要达到实验的目的,需要对产物进行检验,确定其中是否含有碳酸盐。
Ⅰ. 碳酸氢钠分解的方程式为:2NaHCO3![]() Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
Ⅱ. 钠的焰色为黄色,因此高压钠灯发出的光为黄色;
Ⅲ.(1)①碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,反应方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑;
②碳酸钙和盐酸反应的过程中会混有挥发出的HCl,可用饱和的碳酸氢钠溶液吸收;
③装置③中盛放浓硫酸,用于干燥得到的CO2;
(2)①打开弹簧夹K2,关闭K1,干燥的CO2与过氧化钠反应,生成碳酸钠和少量氧气,a处木条无法复燃;打开弹簧夹K1,关闭K2,CO2、水与过氧化钠反应,生成了碳酸钠和较多的氧气,a处的木条可以复燃;
②过氧化钠跟二氧化碳反应,生成碳酸钠和氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2;
(3)①CO2和H2O均可与过氧化钠反应,气体中如有水,水也可与Na2O2反应产生O2使木条复燃;
②若要达到实验的目的,需要对产物进行检验,确定其中是否含有碳酸盐,方法为:加入稀盐酸,将产生的气体通入澄清的石灰水中,观察是否有浑浊生成。


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】清洁能源的开发、废水的处理都能体现化学学科的应用价值。
Ⅰ. 工业上可利用CO2来制备清洁燃料甲醇,有关化学反应如下:
反应A:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
反应B:CO2(g)+H2![]() H2O(g)+CO(g) △H2=+41kJ·mol-1
H2O(g)+CO(g) △H2=+41kJ·mol-1
(1)写出用CO(g)和H2(g)合成CH3OH(g)反应的热化学方程式: _____________________________。
(2)写出两个有利于提高反应A中甲醇平衡产率的条件_______________________。
(3)在Cu-ZnO/ZrO2催化下,CO2和H2混和气体,体积比1∶3,总物质的量amol进行反应,测得CO2转化率、CH3OH和CO选择性随温度、压强变化情况分别如图所示(选择性:转化的CO2中生成CH3OH或CO的百分比)。

温度对反应的影响 压强对反应的影响
由以上两图可知,影响产物选择性的外界条件是______。
A. 温度 B. 压强 C. 催化剂
Ⅱ.实验室模拟“间接电化学氧化法”处理氨氮废水中NH4+的装置如图所示。以硫酸铵和去离子水配制成初始的模拟废水,并以NaCl调节溶液中氯离子浓度,阳极产物将氨氮废水中的NH4+氧化成空气中的主要成分。

(4)阳极反应式为__________________________________。
(5)除去NH4+的离子反应方程式为________________________________________。
Ⅲ.电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理如图所示:

(6)A为_______极,若电解过程中转移1 mol 电子,则膜来两侧电解质溶液的质量变化差(Δm左 -Δm右)为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+KNO3+C→K2S+N2↑+CO2↑(未配平)。关于该反应的说法正确的是( )
A.该反应的还原剂S
B.12gC被消耗时,C得到4mol电子
C.该反应中所有元素均有化合价变化
D.有4mol气体生成时,N原子得到10mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子纳米活性钛无霸是钛氧化物经过光照射,在其表面产生氧化性极强的活性离子,这种活性离子可以分解存在生活空间中的一些有害物质(甲醛、氮氧化物等)。
(1)Ti2+的基态价电子排布式为_______________________。
(2)甲醛分子中C原子轨道杂化类型为____________。1mol甲醛分子中含有σ键的数目为___________。
(3)甲醛易溶于水,除因为它们都是极性分子外,还因为_______________________。
(4)与N2O互为等电子体的一种分子为________________________(填化学式) 。
(5)某含钛化合物晶胞结构如图所示,该化合物的化学式为_____________________。
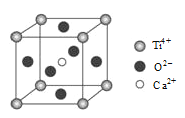
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知T℃时AgCl的Ksp=2×1010;Ag2CrO4是一种橙红色固体,T℃时在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
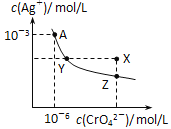
A. T℃时Ag2CrO4的Ksp=1×108
B. Y和Z点Ag2CrO4的Ksp不相同
C. 在饱和Ag2CrO4溶液中加入K2CrO4固体可使溶液由Y点到X点
D. 浓度均为2×106molL﹣1AgNO3与NaCl溶液等体积混合无沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在________下能够导电的化合物叫做电解质。电解质溶液之所以能够导电,是由于它们在溶液中发生了_______,产生了__________。电离时生成的_____离子全部是___的化合物叫做酸;生成的______离子全部是_____的化合物叫做碱。酸碱发生中和反应的实质是_____。(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图用交叉分类法表示了一些概念之间的关系,其中不正确的是( )
X | Y | Z |
| |
A | 硫酸铜 | 盐 | 纯净物 | |
B | 碱性氧化物 | 金属氧化物 | 氧化物 | |
C | 酸性氧化物 | 非金属氧化物 | 氧化物 | |
D | 强电解质 | 电解质 | 化合物 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,物质①4 g H2,② 33.6L CH4,③1mol H2O ,④3.01×1023个O2.(填序号,下同)
(1)质量最大的是________________,(2)分子数最多的是_____________,
(3)原子数最少的是______________,(4)体积最小的是________________.
(5)电子数最多的是_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色晶体。下列说法正确的是
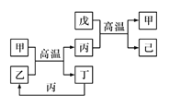
A. W的原子序数是Z的两倍,金属性强于Z
B. W元素在周期表中的位置是第四周期VIII族
C. 丙属于两性氧化物
D. 等物质的量的甲和戊完全溶于稀硝酸,消耗的HNO3的量一定相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com