
【题目】我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+KNO3+C→K2S+N2↑+CO2↑(未配平)。关于该反应的说法正确的是( )
A.该反应的还原剂S
B.12gC被消耗时,C得到4mol电子
C.该反应中所有元素均有化合价变化
D.有4mol气体生成时,N原子得到10mol电子
【答案】D
【解析】
黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,反应方程式为:S+2KNO3+3C=K2S+N2↑+3CO2↑,反应中S、N元素的化合价降低,得到电子,发生还原反应,C元素的化合价升高,失去电子,发生氧化反应,据此分析。
A. 反应中C元素的化合价升高,失去电子,发生氧化,作还原剂,A项错误;
B. C元素的化合价升高,失去电子,12g(即1mol)C被消耗时,C失去4mol电子,B项错误;
C. 该反应中K元素化合价没有变化,C项错误;
D. 有4mol气体生成时,生成N2 ![]() ×4mol=1mol,生成CO2
×4mol=1mol,生成CO2 ![]() ×4mol=3mol,N原子得到10mol电子,D项正确。
×4mol=3mol,N原子得到10mol电子,D项正确。
答案选D。


科目:高中化学 来源: 题型:
【题目】由环己烷可制得1,2—环己二醇,反应过程如下:
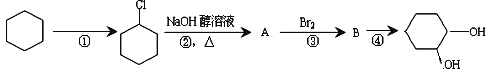
下列说法错误的是
A. ①的反应条件是光照 B. ②的反应类型是消去反应
C. ③的反应类型是取代反应 D. ④的反应条件是NaOH、H2O加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H= -49.0kJ·mol-1。一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示,下列叙述中正确的是
CH3OH(g)+H2O(g) △H= -49.0kJ·mol-1。一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示,下列叙述中正确的是

A.欲增大平衡状态时c(CH3OH)/c(CO2)的比值, 可采用 升高温度的方法
B.3min时,CO2的消耗速率等于CH3OH的生成速率,且二者浓度相同
C.欲提高H2的平衡转化率只能减小反应容器的体积
D.从反应开始到平衡,CO2的平均反应速率v(CO2)=0.025mol·L﹣1·min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】mg气体A和ng气体B的分子数相等,下列说法不正确的是( )
A.同体积的气体A和气体B的质量比为m:n
B.25℃时,1kg气体A和1kg气体B的分子数比为n: m
C.同温同压时气体A和气体B的密度比为n:m
D.标况时,等质量的A和B气体的体积比为n:m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期元素A、B、C、D。A元素M层上有2对成对电子,D与A在周期表中同一主族。由A、B与D组成的化合物的浓溶液是常见的干燥剂,常温下C单质为双原子分子,其氢化物水溶液呈碱性,是一种重要的肥料。
完成下列填空。
(1)A的原子最外层电子排布式为______,该电子层内含______种不同运动状态的电子。描述集气瓶中足量的A的氢化物与其低价态氧化物混合后,充分反应的实验现象:______。
(2)元素A、B与D组成的化合物的浓溶液是常见干燥剂,其化学式是______。写出该化合物在实验室制备乙酸乙酯时所起的作用:______。
(3)B与C元素形成带一个单位正电荷的离子,写出该微粒的电子式___。写出实验室检验溶液中该离子的简单实验方案:_______。
(4)元素A与元素D相比,非金属性较强的是______(用元素符号表示),下列表述中能表明这一事实的是_______。
①比较最高价氧化物对应水化物的酸性
②比较对应气态氢化物的稳定性
③一定条件下D能从A的氢化物水溶液中置换出A单质
④A单质的熔沸点明显高于D单质
(5)C的氢化物固态时属于________晶体,该氢化物与少量A的最高价氧化物水化物反应的化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

A. 图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B. 图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C. 图丙表示催化剂能改变化学反应的焓变
D. 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)![]() N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中发生反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。达到平衡时,下列说法正确的是
2SO3(g) ΔH<0。达到平衡时,下列说法正确的是
容器 | 温度/℃ | 物质的起始浓度/mol·L-1 | 物质的平衡浓度/mol·L-1 | ||
c(SO2) | c(O2) | c(SO3) | c(SO3) | ||
Ⅰ | 758 | 0.2 | 0.1 | 0 | 0.044 |
Ⅱ | 758 | 0.1 | 0.05 | 0 | |
Ⅲ | 858 | 0.2 | 0.1 | 0 | |
A. 从开始至平衡时,容器Ⅰ中SO3的反应速率为0.044 mol·L-1·s-1
B. 平衡时,容器Ⅱ中SO3的浓度小于0.022mol·L-1
C. 平衡时,容器Ⅲ中SO3的浓度大于0.044mol·L-1
D. 若起始时,向容器Ⅰ中充入0.02mol SO2、0.01mol O2和0.02mol SO3,则反应向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠及它们的化合物在生产、生活中有着重要的用途。
Ⅰ.碳酸氢钠可做安全气囊中的冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式是___。
Ⅱ.高压钠灯发光效率高、穿透力强、耗电少,寿命长。这种灯发出的光为___色。
Ⅲ.过氧化钠是重要的工业漂白剂。某课外活动小组设计了下列装置,验证二氧化碳跟过氧化钠反应时需要与水接触。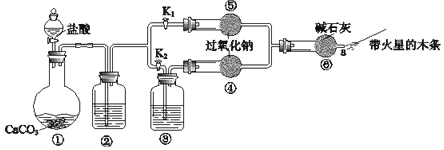
(1)(装置分析)
①装置①中反应的离子方程式是___。
②装置②中的试剂是___(填序号)。
a.饱和NaHCO3溶液 b.饱和Na2CO3溶液 c.浓H2SO4
③装置③中的试剂是___。
(2)(进行实验)
步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
①步骤1和步骤2中,a处带火星的木条产生的实验现象分别是___。
②过氧化钠跟二氧化碳反应的化学方程式是__。
(3)(实验反思)
①有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应。”其理由是__。
②需要补充的实验操作是:取⑤中反应后的少量固体,___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,纵坐标表示电导率,横坐标表示所加溶液的量,以下各组反应符合该图的是(不考虑溶液混合体积的变化)( )
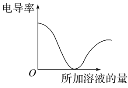
A.向Ba(OH)2溶液中滴加稀H2SO4
B.向NaOH溶液中滴加稀HCl
C.向纯水中加入NaCl溶液
D.向KCl溶液中滴加NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com