
【题目】mg气体A和ng气体B的分子数相等,下列说法不正确的是( )
A.同体积的气体A和气体B的质量比为m:n
B.25℃时,1kg气体A和1kg气体B的分子数比为n: m
C.同温同压时气体A和气体B的密度比为n:m
D.标况时,等质量的A和B气体的体积比为n:m
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】已知25 ℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 |
| Ka=3.0×10-8 |
(1)物质的量浓度均为0.1 mol·L-1的下列四种溶液,pH由小到大排列的顺序是__________(用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1 mol·L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是__________(填字母)。
a. ![]() b.
b. ![]() c.
c. ![]()
d. ![]() e.
e. ![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式__________。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)=__________(填准确数值)。
(5)25℃时,将a mol·L-1的醋酸与b mol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离常数为__________
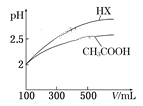
(6)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数__________(填“>”、”=”或“<”)CH3COOH的电离平衡常数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清洁能源的开发、废水的处理都能体现化学学科的应用价值。
Ⅰ. 工业上可利用CO2来制备清洁燃料甲醇,有关化学反应如下:
反应A:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
反应B:CO2(g)+H2![]() H2O(g)+CO(g) △H2=+41kJ·mol-1
H2O(g)+CO(g) △H2=+41kJ·mol-1
(1)写出用CO(g)和H2(g)合成CH3OH(g)反应的热化学方程式: _____________________________。
(2)写出两个有利于提高反应A中甲醇平衡产率的条件_______________________。
(3)在Cu-ZnO/ZrO2催化下,CO2和H2混和气体,体积比1∶3,总物质的量amol进行反应,测得CO2转化率、CH3OH和CO选择性随温度、压强变化情况分别如图所示(选择性:转化的CO2中生成CH3OH或CO的百分比)。

温度对反应的影响 压强对反应的影响
由以上两图可知,影响产物选择性的外界条件是______。
A. 温度 B. 压强 C. 催化剂
Ⅱ.实验室模拟“间接电化学氧化法”处理氨氮废水中NH4+的装置如图所示。以硫酸铵和去离子水配制成初始的模拟废水,并以NaCl调节溶液中氯离子浓度,阳极产物将氨氮废水中的NH4+氧化成空气中的主要成分。

(4)阳极反应式为__________________________________。
(5)除去NH4+的离子反应方程式为________________________________________。
Ⅲ.电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理如图所示:

(6)A为_______极,若电解过程中转移1 mol 电子,则膜来两侧电解质溶液的质量变化差(Δm左 -Δm右)为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子。该厂拟定如图所示的废水处理流程。

回答以下问题:
(1)上述处理废水的流程中主要使用的方法是__________________
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因________________。
(3)②中反应后无气体放出,该反应的离子方程式为___________________。
(4)③中反应时,每0.4mol Cr2O72-转移2.4mol的电子,该反应的离子方程式为______________。
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少,请你使用化学用语,结合必要的文字解释其原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X的蒸气相对氢气的密度为51,X中氧元素的质量分数为31.7%,则能在碱性溶液中发生反应的X的同分异构体有(不考虑立体异构)( )
A. 12种B. 13种C. 14种D. 15种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,在恒容密闭容器中NO2与O2反应为4NO2(g)+O2(g)![]() 2N2O5(g)。(不考虑NO2的分解 ) 若已知该反应是放热反应,则K550℃___K350℃,(填“大于” “等于”或“小于”)。反应达平衡后,若再通入一定量NO2,则平衡常数K将_______,NO2的转化率______。(填“增大”“减小”或“不变”)
2N2O5(g)。(不考虑NO2的分解 ) 若已知该反应是放热反应,则K550℃___K350℃,(填“大于” “等于”或“小于”)。反应达平衡后,若再通入一定量NO2,则平衡常数K将_______,NO2的转化率______。(填“增大”“减小”或“不变”)
(2)若初始时在恒容密闭容器中加入N2O5,下表为N2O5分解反应在一定温度下不同时间测得N2O5浓度的部分实验数据:
t/s | 0 | 500 | 1000 |
c(N2O5) mol/L | 5.00 | 3.25 | 2.48 |
①写出该反应的平衡常数表达式:K=____________。
②1000s内N2O5的分解速率为:_____________。
③若每有1 mol N2O5分解,吸收Q kJ的热量,写出该分解反应的热化学方程式____。
④能使4NO2(g)+O2(g)![]() 2N2O5(g)反应速率增大,且平衡向正反应方向移动的是(_______)
2N2O5(g)反应速率增大,且平衡向正反应方向移动的是(_______)
a.及时分离出N2O5 b.适当提高温度 c.增大O2浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+KNO3+C→K2S+N2↑+CO2↑(未配平)。关于该反应的说法正确的是( )
A.该反应的还原剂S
B.12gC被消耗时,C得到4mol电子
C.该反应中所有元素均有化合价变化
D.有4mol气体生成时,N原子得到10mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子纳米活性钛无霸是钛氧化物经过光照射,在其表面产生氧化性极强的活性离子,这种活性离子可以分解存在生活空间中的一些有害物质(甲醛、氮氧化物等)。
(1)Ti2+的基态价电子排布式为_______________________。
(2)甲醛分子中C原子轨道杂化类型为____________。1mol甲醛分子中含有σ键的数目为___________。
(3)甲醛易溶于水,除因为它们都是极性分子外,还因为_______________________。
(4)与N2O互为等电子体的一种分子为________________________(填化学式) 。
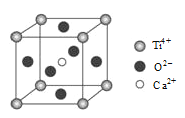
(5)某含钛化合物晶胞结构如图所示,该化合物的化学式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,物质①4 g H2,② 33.6L CH4,③1mol H2O ,④3.01×1023个O2.(填序号,下同)
(1)质量最大的是________________,(2)分子数最多的是_____________,
(3)原子数最少的是______________,(4)体积最小的是________________.
(5)电子数最多的是_______________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com