
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1 L0.1 mol·L-1 氨水中含有0.1NA NH3分子
B.46 g NO2和N2O4混合气体中含有的原子数为3NA
C.1 mol Na2O2中含有的阴离子数为2NA
D.常温常压下,12 g14C所含中子数为6NA
【答案】B
【解析】
A. 1 L0.1 mol·L-1 氨水中含有溶质的物质的量为0.1 mol,其中N元素的存在形式有NH3、NH3·H2O、NH4+,所以含有的NH3分子数目小于0.1NA,A错误;
B. 用极端法计算,若46 g 完全是NO2,其物质的量为0.1 mol,由于1个分子中含有3个原子,则1 mol NO2中含有原子数目为3NA;若46 g完全是N2O4,则其物质的量是0.5 mol,由于1个分子中含有6个原子,则其中含有原子数目为3NA,所以46 g NO2和N2O4混合气体中含有的原子数为3NA,B正确;
C. Na2O2中含有2个Na+和1个O22-,所以1 mol Na2O2中含有的阴离子数为NA,C错误;
D. 14C中含有8个中子,12 g14C所含中子数为![]() ×8NA约等于6.86NA,D错误;
×8NA约等于6.86NA,D错误;
故合理选项是B。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】锑(Sb)及其化合物在工业上有许多用途。以辉锑矿(主要成分为Sb2S3,还含有PbS、As2S3、CuO、SiO2等)为原料制备金属锑的工艺流程如图所示:

已知:① 浸出液中除含过量盐酸和SbCl5之外,还含有SbCl3、PbCl2、AsCl3、CuCl2等;
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度小于等于1.0×10-5mol·L-1时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有___________(填化学式)。
(2)“浸出”时,Sb2S3发生反应的化学方程式为_________________。
(3)“还原”时,被Sb还原的物质为_____________(填化学式)。
(4)常温下,“除铜、铅”时,Cu2+和Pb2+均沉淀完全,此时溶液中的c(S2-)不低于______;所加Na2S也不宜过多,其原因为_____________。
(5)“除砷”时有H3PO3生成,该反应的离子方程式为________________。
(6)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁分子[Fe (C5H5)2]是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法正确的是( )
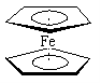
A.二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为离子键
B.1mol环戊二烯(![]() )中含有σ键的数目为5NA
)中含有σ键的数目为5NA
C.二茂铁分子中存在π键
D.Fe2+的电子排布式为1s22s22p63s23p63d44s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
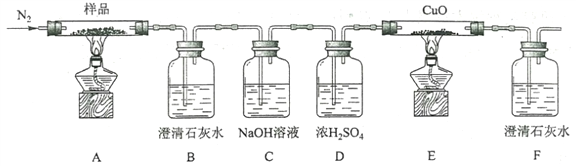
①通入氮气的目的是________________________________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________、___________。
③为防止倒吸,停止实验时应进行的操作是_____________________________。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是( )
A.碳酸氢铵溶液中加入足量的浓氢氧化钠溶液并加热:NH4++OH- =NH3↑+H2O
B.铜与稀硝酸的反应:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
C.向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.过量二氧化硫与氢氧化钠溶液反应:SO2+OH- =HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃既能发生消去反应生成烯烃,又能发生水解反应生成醇的是
①![]() ②CH3CH2CH2Br ③CH3F④CH3CH2Br ⑤C(CH3)3CH2Br⑥CH(CH3)2C(CH3)2Br
②CH3CH2CH2Br ③CH3F④CH3CH2Br ⑤C(CH3)3CH2Br⑥CH(CH3)2C(CH3)2Br
A. ①③⑤B. ②④⑥C. ③④⑤D. ①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用乙烯与甲苯为主要原料,按下列路线可合成有机物E、F:

已知:![]()
请回答:
(1)B中官能团的名称是_________,反应⑥的反应类型是__________。
(2)F的结构简式___________________________。
(3)D→E的化学方程式_________________________________。
(4)下列有关说法不正确的是_________。
A.E能与新制的Cu(OH)2悬浊液发生反应,而B不能与新制的Cu(OH)2悬浊液发生反应
B.![]() 不能使酸性KMnO4溶液褪色
不能使酸性KMnO4溶液褪色
C.1molE和足量H2反应,最多消耗4molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列书写的离子方程式中,正确的是( )。
A. 酸性高锰酸钾溶液与乙二酸(草酸)反应:2MnO![]() +5C2O
+5C2O![]() +16H+===2Mn2++10CO2↑+8H2O
+16H+===2Mn2++10CO2↑+8H2O
B. 在NH4HSO4溶液中缓慢滴入含等物质的量的NaOH的溶液:NH![]() +OH-===NH3·H2O
+OH-===NH3·H2O
C. VO2+与酸性高锰酸钾溶液反应:5VO2++MnO![]() +H2O===5VO
+H2O===5VO![]() +Mn2++2H+
+Mn2++2H+
D. FeI2溶液中滴入过量溴水:2Fe2++2I-+2Br2===2Fe3++I2+4Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们祖先的四大发明之一黑火药的爆炸反应为:S+2KNO3+3C![]() A+N2↑+3CO2↑(已配平)。请回答下列问题:
A+N2↑+3CO2↑(已配平)。请回答下列问题:
(1)生成物固体A属于___________晶体,上述化学反应的氧化剂是__________(写化学式);
(2)硫元素在周期表中的位置为_________能说明氯的非金属性比硫强的实验是_______(任写一条即可);
(3)C原子最外层电子的电子排布式是_____,CCl4是一种常见的有机溶剂,写出其电子式_____,判断其属于_________(填“极性”、“非极性”)共价键_____分子(填“极性”或“非极性”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com