
【题目】某温度下:![]() 。取适量黄色
。取适量黄色![]() 固体配制成100mL溶液,配制过程中溶液的离子浓度与时间的变化关系如图所示。下列说法中正确的是( )
固体配制成100mL溶液,配制过程中溶液的离子浓度与时间的变化关系如图所示。下列说法中正确的是( )
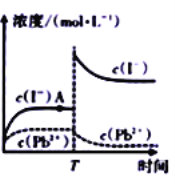
A. A点处可表示![]() 的不饱和溶液
的不饱和溶液
B. T时刻有可能向该![]() 溶液中加人了KI 固体
溶液中加人了KI 固体
C. 常温下![]() 饱和溶液中的
饱和溶液中的![]()
D. 向A点处的![]() 悬浊液中加入
悬浊液中加入![]() 的
的![]() 溶液,平衡后溶液中的c(Pb2+)<4
溶液,平衡后溶液中的c(Pb2+)<4![]() 10-3mol/L
10-3mol/L
【答案】B
【解析】
A.A点c(I-)不再改变,所以可表示PbI2的饱和溶液,故A错误;
B.T时刻c(Pb2+)逐渐减小、c(I-)先增大后减小,所以有可能向该PbI2溶液中加人了KI固体,故B正确;
C.![]() 知PbI2饱和溶液中的
知PbI2饱和溶液中的![]() ,c(I-)=
,c(I-)=![]() ,故C错误;
,故C错误;
D.向A点处的PbI2溶液中加入100mL 2×10-3mol/L的Na2S溶液,溶液体积加倍,c(Pb2+)=5×10-3mol/L,硫离子浓度是1×10-3mol/L,S2-完全反应生成PbS沉淀,剩余c(Pb2+)=4×10-3mol/L,PbS沉淀还存在溶解平衡,所以平衡后溶液中的c(Pb2+)>4×10-3mol/L,故D错误;
答案:B。


科目:高中化学 来源: 题型:
【题目】(题文)[化学——选修5:有机化学基础]
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:

已知:![]()
回答下列问题:
(1)A的化学名称是________________。
(2)B为单氯代烃,由B生成C的化学方程式为________________。
(3)由A生成B、G生成H的反应类型分别是________________、________________。
(4)D的结构简式为________________。
(5)Y中含氧官能团的名称为________________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐中含Ca2+、Mg2+、Fe3+、SO42—等杂质,需要提纯后才能综合利用。为除去粗盐中的杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
(1)提纯的步骤有:①加入过量的Na2CO3溶液②加入过量的BaCl2溶液③加入过量的NaOH溶液④调节溶液的pH等于7⑤溶解⑥过滤⑦蒸发,正确的操作顺序是________(填选项字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
(2)操作Z的名称是_____,蒸发操作用到的仪器有酒精灯,玻璃棒,三脚架,泥三角还有 ________。
(3)第Ⅱ步中,写出除去Ca2+和Fe3+相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2,Fe3+的主要存在形式为FeCl3)____________________、____________________。
(4)判断SO42—已沉淀完全的方法是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和氮及其化合物在生产生活中应用广泛。请回答:
(1)将SO2通入品红溶液中,现象为品红溶液________,加热后溶液颜色________。
(2)已知反应:SO2+Cl2+2H2O ═ 2HCl+H2SO4,该反应中的氧化产物是__________。
(3)木炭与浓硫酸共热的化学反应方程式为:C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O,若生成0.5 mol CO2,则转移电子的物质的量是_________mol。
CO2↑+2SO2↑+2H2O,若生成0.5 mol CO2,则转移电子的物质的量是_________mol。
(4)工业上可以通过氮气和氢气在一定条件下合成氨气。下列关于氨气的性质和用途描述正确的是____________。
A.氨气易液化,液氨可作制冷剂 B.可用排水法收集氨气
C.氨气是一种无色无味的气体 D.向氨水中滴加酚酞,溶液变红
(5)实验室检验试管里氨气是否收集满的方法是___________________(写出一种即可)。
(6)汽车尾气常含有NO、NO2、CO等,会污染空气。在汽车尾气排放管处安装一个催化转化器,可使尾气中有害气体CO和NO反应转化为两种无毒气体,该反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置探究铁在海水中的电化学腐蚀与防护。下列说法不正确的是

A. 若X为锌棒,开关K置于M处,可减缓铁的腐蚀,采用了牺牲阳极的阴极保护法
B. 若X为锌棒,开关K置于N处,X极的反应:4OH--4e-=O2↑+2H2O
C. 若X为碳棒,开关K置于N处,可减缓铁的腐蚀,采用了外加电流的阴极保护法
D. 若X为碳棒,开关K置于M处,X极的反应:O2+4e-+2H2O=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1mol·L-1 的 FeCl3 溶液呈___________性(填“酸”、“碱”或“中”),原因是___(请用离子方程式表示)。电子工业曾用 30%的 FeCl3溶液腐蚀敷有铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得到 FeCl3 溶液,设计如下实验流程:
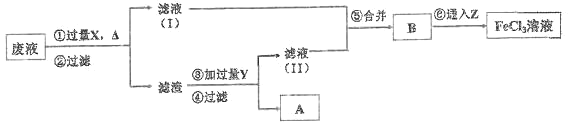
上述流程中,所加试剂的化学式为:X_____,Y_________,Z_____;第⑥步反应的离子方程 式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10℃时加热![]() 饱和溶液,测得该溶液的pH发生如下变化:
饱和溶液,测得该溶液的pH发生如下变化:

(1)![]() 饱和溶液中存在三个平衡关系,写出三个平衡表达式 :________;_______;______。
饱和溶液中存在三个平衡关系,写出三个平衡表达式 :________;_______;______。
(2)甲同学认为,该溶液的pH升高的原因是![]() 的水解程度增大,故碱性增强。乙同学认为,溶液的pH升高的原因是
的水解程度增大,故碱性增强。乙同学认为,溶液的pH升高的原因是![]() 受热分解,生成了
受热分解,生成了![]() ,并推断
,并推断![]() 的水解程度________(填“大于”或“小于”)
的水解程度________(填“大于”或“小于”)![]() 。丙同学认为将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则 ____________(填“甲”或“乙”)判断正确。
。丙同学认为将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则 ____________(填“甲”或“乙”)判断正确。
(3)丁同学向饱和![]() 溶液中加入饱和
溶液中加入饱和![]() 溶液,观察到有白色沉淀和无色气体,经检验该白色沉淀为碳酸钙沉淀,试利用沉淀溶解平衡表达式和K、Q关系分析产生该沉淀的原因 ____________。
溶液,观察到有白色沉淀和无色气体,经检验该白色沉淀为碳酸钙沉淀,试利用沉淀溶解平衡表达式和K、Q关系分析产生该沉淀的原因 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述不正确的是( )

A.WZ的水溶液呈中性
B.元素非金属性的顺序为X< Y< Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上消除氮氧化物的污染,可用如下反应:![]()
![]() 在温度
在温度![]() 和
和![]() 时,分别将
时,分别将![]() 和
和![]() 充入体积为1L的密闭容器中,测得
充入体积为1L的密闭容器中,测得![]() 随时间变化数据如下表:下列说法错误的是( )
随时间变化数据如下表:下列说法错误的是( )
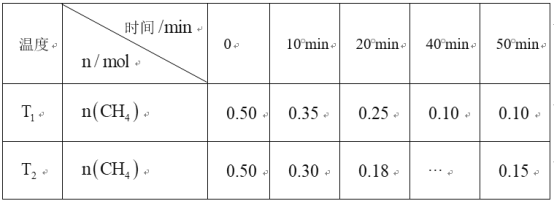
A.10min内,![]() 时
时![]() 的化学反应速率比
的化学反应速率比![]() 时小
时小
B.温度:![]()
C.![]()
D.平衡常数:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com