
【题目】常温下,XOH、YOH及ZOH三种一元碱的物质的量浓度均为0.100 mol·L-1,体积均为10.00 mL,分别用0.100 mol·L-1的HCl溶液滴定,滴定曲线如图所示。下列说法正确的是
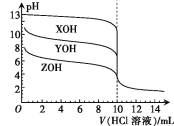
A.均可用酚酞作指示剂
B.电离平衡常数:Kb(YOH)<Kb(ZOH)
C.均滴入10.00 mL HCl溶液时,ZCl溶液中的水解程度最大
D.pH=11的YOH与pH=3的HCl溶液等体积混合:c(Cl-)>c(Y+)>c(H+)>c(OH-)
【答案】C
【解析】
0.1mol/L的XOH溶液pH=13,说明XOH完全电离,为强碱;而YOH、ZOH为弱碱,三者碱性强弱为XOH>YOH>ZOH,都滴入10.00 mL HCl溶液时均恰好完全反应生成正盐,YCl、ZCl要水解,且ZCl水解程度更大。
A、XOH为强碱,YOH、ZOH为弱碱,用盐酸滴定弱碱时应用甲基橙做指示剂,故A错误;
B、有图像看出,YOH、ZOH的物质的量浓度均为0.100 mol·L-1时,YOH溶液的pH更大,则碱性更强,所以电离平衡常数Kb(YOH)>Kb(ZOH),故B错误;
C、均滴入10.00 mL HCl溶液时,YCl、ZCl要水解,而ZOH碱性最弱,所以ZCl水解程度最大,故C正确;
D、YOH时弱碱,pH=11的YOH与pH=3的HCl溶液等体积混合时,YOH过量,溶液应显碱性,离子浓度顺序为:c(Y+) > c(Cl-) > c(OH-) > c(H+),故D错误。
答案选C。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)以下是日常生活中常见的一些物质:①液氯、②酒精、③CO2、④熟石灰、⑤碳酸钠、⑥稀盐酸、⑦CaO、③Na2O2、⑨Cu,请你指出(填写序号):
属于碱性氧化物的是___;能导电的是___。
(2)胶体粒子直径在___nm之间
Ⅱ.化学计量在化学中占有重要地位。根据计算填空:
(1)实验室某浓盐酸的质量分数为36.5%,密度为1.20g·cm-3,此浓盐酸的物质的量浓度是___mol·L-1;
(2)6.8gH2O2与标准状况下___LCO2所含氧原子数相同;
Ⅲ.除去Mg粉中的Al粉,指明应加入的试剂,写出有关的离子反应方程式。
Mg粉(Al粉):试剂___,离子方程式____。
IV.配平如下方程式
___NaClO+___NH3·H2O=___N2H4+___NaCl+___H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
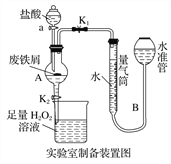
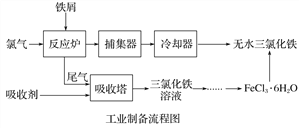
【题目】氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下:
已知:(1)无水FeCl3的熔点为555 K、沸点为588 K。
(2)废铁屑中的杂质不与盐酸反应。
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸;
Ⅱ.当……时,关闭弹簧夹K1,打开活塞K2,当A中溶液完全进入烧杯后关闭活塞a;
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。
请回答:
(1)烧杯中足量的H2O2溶液的作用是_____________________________。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是______________。
(3)从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是加入______________后__________________、过滤、洗涤、干燥。
(4)试写出吸收塔中反应的离子方程式:______________________。
(5)捕集器温度超过673 K时,存在相对分子质量为325的铁的氯化物,该物质的分子式(相对原子质量:Cl-35.5、Fe-56)为____________。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100 mL溶液;取出10.00 mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol·L-1 Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-=2I-+S4O62-)。
①滴定终点的现象是________________________________________________;
②样品中氯化铁的质量分数为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素。如图是实验室从海藻里提取碘的流程的一部分。下列判断正确的是
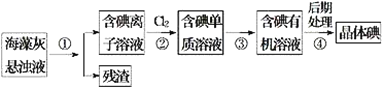
A. 步骤④的操作是过滤
B. 可用淀粉溶液检验步骤②的反应是否进行完全
C. 步骤①、③的操作分别是过滤、萃取
D. 步骤③中加入的有机溶剂可能是酒精或四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志,F是一种常见的高分子材料。根据下面转化关系回答下列问题:

(1)操作⑥、操作⑦的名称分别为________、________。
(2)下列物质中沸点最高的是________。
A 汽油 B 煤油
C 柴油 D 重油
(3)在①~⑤中属于取代反应的是________;原子利用率为100%的反应是________。(填序号)
(4)写出结构简式:A________、F________。
(5)写出反应③的离子方程式:___________。
(6)作为家庭中常见的物质F,它给我们带来了极大的方便,同时也造成了环境污染,这种污染称为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Co(CH3COO)2·4H2O(乙酸钴)是一种重要的有机化工原料。回答下列问题:
(1)以工业品氧化钴(CoO)为原料制备乙酸钴。(已知CoO与CH3COOH溶液反应缓慢,Co2+能与H+、NO3-大量共存)可能用到的试剂:Na2CO3溶液、CH3COOH溶液、HNO3溶液。先将CoO溶于____(填化学式,下同)溶液制得____溶液;在不断搅拌下,向制得的溶液中不断加入____溶液至不再产生沉淀,静置,过滤,洗涤;向沉淀中加入___溶液至沉淀完全溶解,调节pH约为6.8,经一系列操作得Co(CH3COO)2·4H2O。
(2)为探究乙酸钴的热分解产物,先在低于100 ℃时使其脱去结晶水,然后用下列装置进行实验(已知CO能与PdCl2溶液反应生成黑色Pd沉淀):
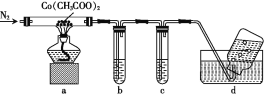
①通N2的目的是______。
②澄清石灰水和PdCl2溶液分别用于检验CO2和CO,其中盛放PdCl2溶液的装置是____(填字母)。
③实验结束时,为防止倒吸,正确的操作是______。
④装置a中完全反应后得到钴的一种氧化物,固体残留率(![]() ×100%)为45.4%。该氧化物为____。
×100%)为45.4%。该氧化物为____。
⑤装置a在加热过程中没有水生成,最终生成的固体氧化物质量为3.0125 g,装置b和c中的试剂均足量(b、c中得到固体的质量分别为2.5 g、10.6 g),集气瓶中收集到的气体为C2H6和N2,则装置a中发生反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3===2NaNH2+H2↑ B.2NH3+3CuO===3Cu+N2+3H2O
C.4NH3+6NO===5N2+6H2O D.HNO3+NH3===NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣===NO2-+NO3-+H2O和NO+NO2+2OH﹣===□ +H2O(配平该方程式)。______________
(3)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
①Cu与稀HNO3反应的离子方程式为__。
②Cu与Cu2O 的物质的量之比为__。
③HNO3的物质的量浓度为__mol·L-1。
(4)有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是

A. 反应的化学方程式为2X(g)+Y(g)![]() 2Z(g)
2Z(g)
B. 反应开始到10 s,用Z表示的反应速率为0.3 mol·L-1·s-1
C. 10 s后,该反应停止进行
D. 反应开始到10 s时,反应速率:υ(X)=υ(Y)=0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol 硫酸钠的溶液恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
A. 0.1(b-2a)mol/LB. 10(2a-b)mol/LC. 10(b-a)mol/LD. 10(b-2a)mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com