
I.设反应①Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
|
T(K) |
K1 |
K2 |
|
973 |
1.47 |
2.36 |
|
1173 |
2.15 |
1.67 |
(1)现有反应③CO2(g)+H2(g)  CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有
(填序号)。
CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有
(填序号)。
A.缩小反应容器容积
B.扩大反应容器容积
C.降低温度
D.升高温度
E.使用合适的催化剂
F.设法减少CO的量
(2)若反应Fe(s)+CO2(g)  FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
 FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)。
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)。
A.前者大 B.后者大 C.一样大 D.无法判断
II.(1)钢铁的表面发蓝、发黑处理是常用的防腐方法。请配平主要反应的方程式:
□Na2FeO2+□NaNO2+□H2O=□NaFeO2+□NH3↑+□NaOH
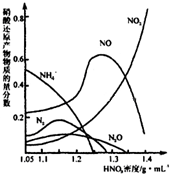
(2)钢铁经冷、浓HNO3处理后“钝化”能达到防腐目的,不同浓度的HNO3与铁反应的还原产物很复杂,其分布曲线如图。

①图示可知,分析HNO3与铁反应的规律是 。
②工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是 。
(3)金属(M)的腐蚀是因为发生反应:M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是 (填字母编号)
A.在铁中掺入铬等金属制成不锈钢
B.在铁制品表面镀锌
C.提高铁中含碳量,制成生铁
D.将水库铁闸门与直流电源的负极相连
I.(1)吸热(2分)D、F(2分)
(2)A(2分)
Ⅱ.(1)6Na2FeO2+NaNO2+5H2O=6NaFeO2+NH3+7NaOH(2分)
(2)①硝酸的浓度越大,其还原产物中氮元素化合价越高(2分)
(其它合理答案均给分,如硝酸的浓度越大,气体生成物中二氧化氮的含量越高;或者,只有硝酸浓度较低时,产物中才会出现氮气;等等)
②硝酸易挥发,且不稳定,见光易分解,故不易操作(1分)生成物对环境污染严重(1分)
(3)A、B、D(2分)
(对一个或两个给1分,全对给2分,但只要出现C不给分)
【解析】
试题分析:已知:①Fe(s)+CO2(g) FeO(s)+CO(g);②Fe(s)+H2O(g)
FeO(s)+CO(g);②Fe(s)+H2O(g) FeO(s)+H2(g);利用盖斯定律将①-②可得:③H2(g)+CO2(g)
FeO(s)+H2(g);利用盖斯定律将①-②可得:③H2(g)+CO2(g) CO(g)+H2O(g);
CO(g)+H2O(g);
则K3=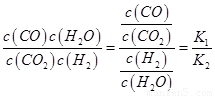 ,依据图表平衡常数数据分析,温度升高
,依据图表平衡常数数据分析,温度升高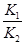 增大,说明平衡正向进行,反应是吸热反应;③H2(g)+CO2(g)
增大,说明平衡正向进行,反应是吸热反应;③H2(g)+CO2(g) CO(g)+H2O(g)反应是吸热反应,反应前后气体体积不变,要使反应在一定条件下建立的平衡向正反应方向移动,则
CO(g)+H2O(g)反应是吸热反应,反应前后气体体积不变,要使反应在一定条件下建立的平衡向正反应方向移动,则
A.缩小反应容器容积实质增大压强,反应前后气体体积不变,平衡不动;A不符合;
B.扩大反应容器容积,压强减小,反应前后气体体积不变,平衡不动;B不符合;
C.反应是吸热反应,降低温度,平衡向放热反应方向进行,平衡逆向进行,C不符合;
D.反应是吸热反应,升高温度,平衡向吸热反应方向进行,平衡正向进行,D符合;
E.使用合适的催化剂,催化剂只改变反应速率,不改变平衡,E不符合;
F.设法减少CO的浓度,减少生成物浓度平衡正向进行,F符合;
答案为:吸热反应;DF;
(2)反应速率随温度变化,温度越高,反应速率越大,所以反应速率①大,选A.
Ⅱ、(1)Na2FeO2+NaNO2+H2O→NaFeO2+NH3↑+NaOH中,铁元素化合价从+2价变化为+3价,氮元素化合价从+3价变化为-3价,Na2FeO2~NaFeO2~e-,NaNO2~NH3~6e-,依据电子守恒Na2FeO2的配平系数为6,NaFeO2的配平系数为6,NaNO2和NH3的配平系数为1,依据原子守恒配平NaOH,配平系数为7,H2O的配平系数为5,化学方程式为:
6Na2FeO2+NaNO2+5H2O=6NaFeO2+NH3↑+7NaOH,
答案为:6Na2FeO2+NaNO2+5H2O=6NaFeO2+NH3↑+7NaOH;
(2)①硝酸的浓度越大,气体生成物中二氧化氮的含量越高,只在硝酸浓度较低时,产物中才会出现氮气,答案为:硝酸浓度越大,其还原产物中氮元素的价态越高;
②工业上一般不用冷浓硝酸进行铁表面处理,浓硝酸具有易挥发,见光分解,生成产物污染空气等性质,答案为:硝酸易挥发,不稳定,见光易分解,故不易操作,生成物对环境污染严重;
(3)金属(M)的腐蚀是因为发生反应:M-ne-→Mn+,防止腐蚀是避免金属失电子腐蚀反应;
A.在铁中掺入铬等金属制成不锈钢,原因是用铬对钢进行合金化处理时,把表面氧化物的类型改变成了类似于纯铬金属上形成的表面氧化物.这种紧密粘附的富铬氧化物保护表面,防止进一步地氧化.这种氧化层极薄,透过它可以看到钢表面的自然光泽,使不锈钢具有独特的表面.而且,如果损坏了表层,所暴露出的钢表面会和大气反应进行自我修理,重新形成这种“钝化膜“,继续起保护作用,A符合;
B.在铁制品表面镀锌,锌比铁活泼做原电池负极,铁做正极被保护,B符合;
C.提高铁中含碳量,制成生铁,含碳越高,碳和铁在电解质溶液中越易形成原电池,铁做负极被腐蚀,C不符合;
D.将水库铁闸门与直流电源的负极相连,形成电解池,闸门做阴极被保护,D符合;
选ABD.
考点:化学平衡常数的含义;氧化还原反应方程式的配平;化学反应速率的影响因素;化学平衡的影响因素;金属防护的常用方法


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:阅读理解
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 I.高炉炼铁中发生的基本反应之一是FeO(s)+CO(g)?Fe(s)+CO2(g)△H>0.其平衡常数可表达为k=c(CO2)/c(CO),已知1100℃时,k=0.263.
I.高炉炼铁中发生的基本反应之一是FeO(s)+CO(g)?Fe(s)+CO2(g)△H>0.其平衡常数可表达为k=c(CO2)/c(CO),已知1100℃时,k=0.263.查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省高三上学期12月月考化学试卷(解析版) 题型:填空题
I.设反应①Fe(s)+CO2(g)  FeO(s)+CO(g)的平衡常数为K1。
FeO(s)+CO(g)的平衡常数为K1。
反应②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常数为K2,
FeO(s)+H2(g)的平衡常数为K2,
在不同温度下,K1、K2的值如下:
|
T(K) |
K1 |
K2 |
|
973 |
1.47 |
2.36 |
|
1173 |
2.15 |
1.67 |
(1)现有反应③CO2(g)+H2(g)
 CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有
(填序号)。
CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有
(填序号)。
A.缩小反应容器容积
B.扩大反应容器容积
C.降低温度
D.升高温度
E.使用合适的催化剂
F.设法减少CO的量
(2)若反应Fe(s)+CO2(g)
 FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
 FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率
(填序号)
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率
(填序号)
A.前者大 B.后者大 C.一样大 D.无法判断
II.(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。则100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=________mol·L-1,KW(25℃)________KW(100℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4HCO3固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
|
化学式 |
电离平衡常数(25℃) |
|
HCN |
K=4.9×10-10 |
|
CH3COOH |
K=1.8×10-5 |
|
H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为 ____。
②25 ℃时,相同浓度、相同体积的CH3COOH溶液和NaOH溶液混合, 则混合溶液中c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
I.设反应①Fe(s)+CO2(g) ![]() FeO(s)+CO(g)的平衡常数为K1。
FeO(s)+CO(g)的平衡常数为K1。
反应②Fe(s)+H2O(g) ![]() FeO(s)+H2(g)的平衡常数为K2,
FeO(s)+H2(g)的平衡常数为K2,
在不同温度下,K1、K2的值如下:
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
(1)现有反应③CO2(g)+H2(g) ![]() CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号)。
CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号)。
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(2)若反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g) ![]() FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率
(填序号)
A.前者大 B.后者大 C.一样大 D.无法判断
II.(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。则100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=________mol·L-1,KW(25℃)________KW(100℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4HCO3固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。

(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为_______ ____。
②25 ℃时,相同浓度、相同体积的CH3COOH溶液和NaOH溶液混合,
则混合溶液中c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为
___________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com