
【题目】某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是( ) 
A.a电极上发生的反应为:MnO4﹣+8H++5e﹣═Mn2++4H2O
B.外电路电子的流向是从a到b
C.电池工作时,盐桥中的SO42﹣移向甲烧杯
D.b电极上发生还原反应
【答案】A
【解析】解:A、甲烧杯中发生还原反应,Mn元素的化合价降低,电极反应为MnO4﹣+8H++5e﹣═Mn2++4H2O,故A正确;
B、由上述分析可知,a为正极,电子由负极流向正极,即从b流向a,故B错误;
C、阴离子向负极移动,则盐桥中的SO42﹣移向乙烧杯中,故C错误;
D、b为负极,负极发生氧化反应,故D错误;
故选A.
由2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,则b为负极,a为正极,结合原电池中负极发生氧化反应,电流从正极流向负极,阴离子向负极移动来解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】对可逆反应aA(g)+bB(g)![]() cC(g)+dD(g),达到平衡时,各物质的物质的量浓度应满足以下关系:
cC(g)+dD(g),达到平衡时,各物质的物质的量浓度应满足以下关系:![]() =K,K为一常数,称为化学平衡常数,其反应的K值只与温度有关,现有反应:CO(g)+H2O(g)
=K,K为一常数,称为化学平衡常数,其反应的K值只与温度有关,现有反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,在850℃时,K=1。
CO2(g)+H2(g) ΔH<0,在850℃时,K=1。
(1)若升高温度到950℃,达到平衡时K________(填“大于”、“小于”或“等于”)1。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向________(填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明星药物青蒿素的分子式为C15H22O5 , 键线式为 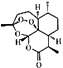 .关于它的说法中,正确的是( )
.关于它的说法中,正确的是( )
A.青蒿素是一种氧化物
B.青蒿素中氧元素的质量分数为11.9%
C.青蒿素中C,H,O三种元素的质量比为90:11:40
D.青蒿素是由15个碳原子、22个氢原子和5个氧原子构成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥ 浓HNO3,其中在常温下能与SiO2反应的有 ( )
A. ①②⑥ B. ①③ C. ①③⑤ D. ②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下: ①配制混酸:组装如图反应装置.取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中.把18 mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50﹣60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.已知
(i) ![]() +HNO3(浓)
+HNO3(浓) ![]()
![]() +H2O
+H2O 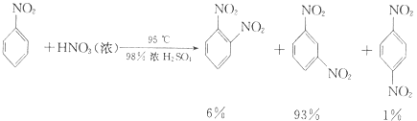
(ii)可能用到的有关数据列表如下
物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/gcm﹣3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
1,3﹣二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
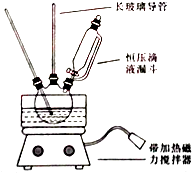
请回答下列问题:
(1)配置混酸应先在烧杯中先加入 .
(2)恒压滴液漏斗的优点是 .
(3)实验装置中长玻璃管可用代替(填仪器名称).
(4)反应结束后产品在液体的层(填“上”或者“下”),分离混酸和产品的操作方法为
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? .
(6)为了得到更纯净的硝基苯,还须先向液体中加入除去水,然后蒸馏,最终得到17.5g硝基苯,则硝基苯的产率为(保留两位有效数字).若加热后,发现未加沸石,应采取的操作是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):
(1)B,C,D中第一电离最大的元素其基态原子有种不同能量的电子.
(2)G分子中D原子的杂化方式为 , F2+的基态价电子排布式为 .
(3)BA3﹣离子的空间构型为 , 与其互为等电子体的一种阳离子的电子式为 .
(4)某化合物晶胞结构如图所示,E2+的配位数是 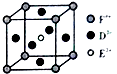
(5)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子.
①释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因是
②由H分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2水溶液反应的离子方程式;该阳离子还能与H分子作用生成羟基,经测定此时的H具有酸性,写出该过程的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是高中阶段学习的常见单质或化合物,金属单质A在常温下可以和氧气生成化合物C,且A可以和氢氧化钠溶液反应。化合物E淡黄色物质,可用于呼吸面具,可由一种活泼金属D在氧气中燃烧得到。单质B是所含元素在地壳中含量居于第四。回答问题:
(1)物质E的化学式___________,E与水反应的离子方程式____________________。
(2)单质A与NaOH反应的离子方程式_______________________,化合物C与硫酸反应的离子方程式:_______________________________。
(3)单质B与水蒸汽反应的化学方程式为___________________________________。
(4)单质D与CuSO4溶液反应的化学方程式为__________________________。
(5)活泼金属D与水的反应中,做___________(填“氧化剂”或“还原剂”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com